题目内容
5.实验室部分装置如图1,请回答下列问题: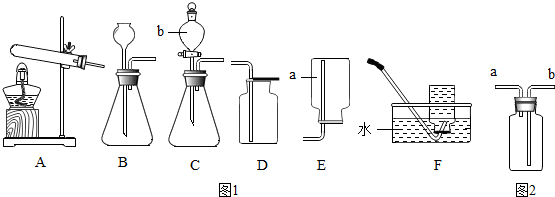
(1)写出图中带有标号仪器的名称:a集气瓶,b分液漏斗.
(2)实验室若用装置B制取氧气,则发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.若用装置A制取氧气,药品选用氯酸钾和二氧化锰,该装置中试管口略向下倾斜的原因是防止水蒸气冷凝、回流炸裂试管.
(3)实验室用大理石和稀盐酸制取二氧化碳的发生装置为C(填字母),你所选择的发生装置的优点是能够控制反应速率.
(4)若用图2中装置通过排空气法收集一瓶氧气,氧气应从b(填“a”或“b”)端进入.
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
(4)根据气体的性质可以判断收集气体的方法.
解答 解:(1)a是集气瓶,常用来收集气体;b是分液漏斗,通过分液漏斗可以向反应容器中注入液体药品.
故填:集气瓶;分液漏斗.
(2)实验室若用装置B制取氧气不需要加热,应该是利用过氧化氢制取氧气,则发生反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
用装置A制取氧气需要加热,因为试管口没有塞一团棉花,应该是利用氯酸钾制取氧气,药品选用氯酸钾和二氧化锰,该装置中试管口略向下倾斜的原因是防止水蒸气冷凝、回流炸裂试管.
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;氯酸钾和二氧化锰;防止水蒸气冷凝、回流炸裂试管.
(3)实验室用大理石和稀盐酸制取二氧化碳不需要加热,选择的发生装置为C装置,C发生装置的优点是:通过分液漏斗可以控制液体药品的流量,从而可以控制反应速率.
故填:C;能够控制反应速率.
(4)若用图2中装置通过排空气法收集一瓶氧气,由于氧气的密度比空气大,氧气应从b端进入.
故填:b.
点评 本题主要考查仪器的用途、反应表达式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.

| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH-,没有H+、NH4+ |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
| A. | 紫色的石蕊试液 | B. | 无色的酚酞试液 | C. | CO2气体 | D. | 稀盐酸 |
| 组别 | 要解决的问题 | 所用方法 |
| A | 鉴别二氧化碳气体和氦气 | 用燃着的小木条 |
| B | 鉴别腈纶和羊毛 | 灼烧闻气味 |
| C | 分离食盐和硝酸钾 | 溶解过滤 |
| D | 电线着火了 | 先切断电源,再进行灭火 |
| A. | 用汽油、洗涤剂都能洗去油污,二者都是利用溶解作用 | |
| B. | 从5%的蔗糖溶液中取出1滴,这1滴溶液的浓度仍为5% | |
| C. | 酸、碱、盐的溶液能导电,是因为溶液中存在自由移动的离子 | |
| D. | 在配制溶液时,所用的溶质可以是固体、液体,也可以是气体 |
| A. | 浓硫酸 | B. | 铁粉 | C. | 烧碱 | D. | 浓盐酸 |
实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等
(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应.反应的化学方程式为NaOH+HCl═NaCl+H2O.
(2)小刚取体积相同的稀盐酸分别于甲、乙两支试管中,向甲中先加1mL水,充分混合后再放入镁条,向乙中先加入1mL NaOH溶液,充分混合后再放入镁条.观察到甲中有气泡冒出,乙中无气泡(或气泡少),可推断NaOH与盐酸发生了反应.
(3)小华利用溶液导电性进行实验.分别测定几种试剂的导电性,获得相关数据:
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
Ⅰ.溶液中若存在自由移动的离子,通电时就会发生定向移动,从而形成了电流.
Ⅱ.相同电压下,等体积溶液中,所含离子数目越多,电流就越大.
①对比实验A、C的数据,可推知NaOH溶液中除水分子外还含有自由移动的Na+和OH-(填化学符号).
②实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等(填写“相等”或“不相等”).
③各取10mL NaOH溶液于两个小烧杯中,分别加入10mL NaCl溶液和10mL稀盐酸(所得混合溶液体积均约为20mL),测两种混合溶液的导电性,电流示数依次为I1和I2.根据I1> I2(填“>”、“<”或“=”),也可推断氢氧化钠和盐酸发生了反应.
(1)甲组:按如下设计的方案实验,请完成表1:
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| Ⅰ | 探究溶液的浓度对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 10mL 4%H2O2 |
| Ⅱ | 25℃ | 0.2gMnO2 | 10mL 8%H2O2 |
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 实验时溶液 酸碱度 |
| Ⅰ | 探究溶液的酸碱性 对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 0mL 8%H2O2 | pH=10.0 |
| Ⅱ | 25℃ | 0.2gMnO2 | 0mL 8%O2 | pH=4.0 |

①从甲组实验得出的数据可知:H2O2浓度越大,分解速率越快.
②由乙组研究的影响H2O2分解因素的数据分析:相同条件下,H2O2在碱性(填“酸性”或“碱性”)环境下放出气体速率较快;写出H2O2分解的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
【发现问题】实验开始时,H2O2溶液的温度为25℃;实验结束时,溶液的温度明显升高.说明H2O2分解是放热(选填“放热”或“吸热”)反应.
【注意:若答对第(5)小题将奖励 4分,化学卷总分不超过60分】
【反思运用】同学们经过讨论、交流和网上搜资料,提出下面两种制取H2O2液的方 法:
①用Na2O2(过氧化钠)与 H2SO4溶液作反应物,反应时将温度控制在-5~+5℃范围,生成的Na2SO4,会以
Na2SO4•10H2O晶体的形式析出,反应原理为 Na2O2+H2S04+10H2O═NaSO4•10H2O+H20,制取时Na2O2的量不能过量,因为Na2O2与水反应会生成NaOH.若Na2O2过量会造成(在碱性环境中)生成的过氧化氢分解.
②用BaO2(过氧化鋇)与H2SO4溶液作反应物.在常温下就可反应生成H2O2,试写出反应的化学方程式BaO2+H2SO4=BaSO4↓+H2O2.方法“②”比方法“①”更易操作,理由是方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
 在做完常见酸碱盐性质的实验后,课外小组的同学帮助老师整理实验用品,发现有一个失去标签的试剂瓶(如图),里面盛有无色、无味的液体,老师建议他们通过实验方法给予确认,大家进行了讨论和探究.请你也来参与吧.
在做完常见酸碱盐性质的实验后,课外小组的同学帮助老师整理实验用品,发现有一个失去标签的试剂瓶(如图),里面盛有无色、无味的液体,老师建议他们通过实验方法给予确认,大家进行了讨论和探究.请你也来参与吧.