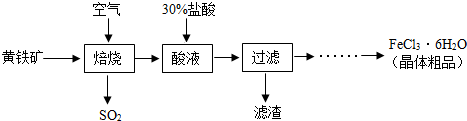
题目内容
8.氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)氨气易与酸反应.
【设计实验】
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
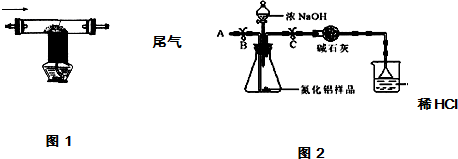
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
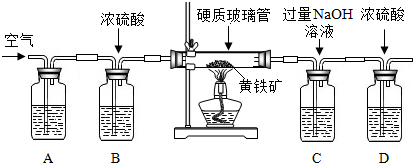
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
【实验讨论】
(1)步骤①加入样品前还应检查装置气密性.
(2)装有碱石灰的干燥管作用是除去气体中的水;装置中使用漏斗的目的是防止液体倒吸.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是浓盐酸具有挥发性;
(4)步骤④的目的是使反应产生的氨气充分吸收.
【实验结论】
所制氮化铝样品中氮化铝的质量分数为90%
【事故处理】
实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
【拓展探究】
(1)实验后剩余的浓NaOH溶液不能(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液20g.
分析 【实验一】
1、根据用灼热的铜网除去空气中的氧气进行解答;
2、根据对反应的说明,在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,写出反应的化学方程式;
【实验二】
【实验讨论】(1)根据对实验操作中需要确保装置气密性的认识,判断实验开始之前应进行的操作;
(2)根据装置中药品或仪器的使用方法,分析实验中所涉及装置的作用,判断所指定装置对实验的影响;
(3)对比稀盐酸、浓盐酸、浓硫酸与稀硫酸在实验中作用的异同来判断;
(4)分析缓缓通入空气的操作对实验中残留气体的影响,推断该操作在实验过程中的目的;
【实验结论】利用所测得氨气的质量,根据反应的化学方程式计算出样品中氮化铝的质量,从而求出样品中氮化铝的质量分数.
事故处理:利用氢氧化钠的性质解答;
拓展探究:(1)剩余的剩余的浓NaOH溶液不能放回原试剂瓶,以免污染药品;
(2)利用AlN+NaOH+H2O=NaAlO2+NH3↑,求出NaOH的质量,进而求出浓氢氧化钠溶液的质量.
解答 解:【实验一】
(1)用灼热的铜网除去空气中的氧气,化学方程式为:2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO;
(2)根据信息:在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,装置D中发生反应化学方程式为:N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
【实验二】
【实验讨论】(1)在进行实验前要确保装置气密性良好,因此应先进行气密性的检查;
(2)碱石灰能吸收气体中的水,防止水对测量质量的影响;使用漏斗进行氨气的吸收,可以防止吸收过程中造成溶液的倒吸;
(3)浓盐酸具有挥发性,使测量氨气质量偏小;若使用浓硫酸,浓硫酸吸收空气中的水,使得测量氨气质量偏大,而使结果偏大;可以用稀硫酸代替盐酸;
(4)从导管A处缓缓鼓入一定量的空气,可以使装置内残留的氨气全部被稀硫酸吸收,以保证实验的准确性;
【实验结论】反应生成氨气的质量=203.4g-200g=3.4g,设氮化铝的质量为xg
AlN+NaOH+H2O═NaAlO2+NH3↑
41 17
x 3.4g
$\frac{41}{x}=\frac{17}{3.4g}$
x=8.2g
样品中的氮化铝的质量分数=$\frac{8.2g}{9.1g}$×100%=90%.
事故处理:浓氢氧化钠具有强腐蚀性,不小心将盛有约50mL的浓NaOH溶液打翻在桌面上,立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
拓展探究:(1)实验后剩余的浓NaOH溶液不能放回原试剂瓶,以免污染药品;NaOH溶液露置在空气中和二氧化碳反应,化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(2)利用AlN+NaOH+H2O=NaAlO2+NH3↑,求出NaOH的质量,进而求出浓氢氧化钠溶液的质量;
设ygNaOH与8.2gAlN完全反应
AlN+NaOH+H2O=NaAlO2+NH3↑
41 40
8.2g y
$\frac{41}{8.2g}=\frac{40}{y}$
y=8g
浓氢氧化钠溶液的质量:8g÷40%=20g.
故答案为:
【实验一】
(1)2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO;(2)N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
【实验二】
【实验讨论】(1)装置气密性;
(2)除去气体中的水;防止液体倒吸;
(3)浓盐酸具有挥发性;
(4)使反应产生的氨气充分吸收;
【实验结论】90;
事故处理:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干;
拓展延伸:(1)不能;2NaOH+CO2═Na2CO3+H2O;
(2)20.
点评 通过阅读整个实验过程,理解实验的原理、操作方法及实验目的,为解答此类问题所要着力完成的基础.

[设计实验]
用一氧化碳还原纯净的氧化铁粉末,实验装置如图.
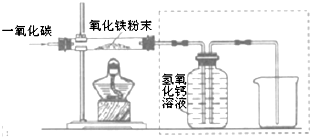
[进行实验]
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
[实验与猜想]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能
a.全部为铁 b.全部是四氧化三铁 c铁与四氧化三铁的混合物.
[得出结论]
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)四氧化三铁.
[反思与评价]
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有A、B.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
| A. | 7.2g | B. | 5.8g | C. | 4.4g | D. | 9.5 g |
| A. | 用铝锅盛放酸性食物 | B. | 菜刀使用后放在潮湿的砧板上 | ||
| C. | 塑料器皿使用时应避免接触火源 | D. | 用水浇灭锅中着火的油 |
| A. | 稀有气体用于制作霓虹灯 | B. | 木头制作桌椅 | ||
| C. | 氮气作保护气 | D. | 铜线制作电缆 |
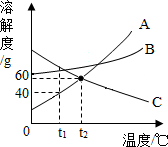 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.