题目内容
3.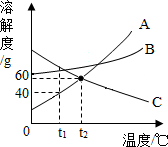 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.(1)t1℃时,A物质的饱和溶液中溶质的质量分数是28.6%.
(2)t2℃时,能配成溶质质量分数相同的A和C的饱和溶液.(填“能”或“不能”).
(3)使t1℃时C物质的不饱和溶液都变成饱和溶液,采用的方法是升温(写一条).
(4)t2℃时,B物质的溶解度大于 C物质的溶解度(填“大于”、“小于”或“等于”).
分析 根据溶解度曲线的意义进行分析解答,在同一温度下,对应的溶解度曲线越高,则溶解度越大;饱和溶液是指在一定温度下在一定量的溶剂里不能再溶解某种溶质的溶液,据此解答.
解答 解:(1)t1℃时,A的溶解度为40g,故A物质的饱和溶液中溶质的质量分数是:$\frac{40g}{100g+40g}×100%$≈28.6%,故填:28.6%;
(2)t2℃时,A和C的溶解度相等,故能配成溶质质量分数相同的A和C的饱和溶液,故填:能;
(3)使t1℃时C物质的不饱和溶液都变成饱和溶液,可以采用升温或减少溶剂或增加溶质的方法,故填:升温;
(4)t2℃时,B物质的溶解度大于C物质的溶解度,故填:大于,
点评 明确溶解度定义及曲线的含义是解答本题关键.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
13.下列实验方案中合理的是( )
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去氮气中少量氧气 | 通过灼热的氧化铜 |
| B | 除去硝酸钾中的氯化钠 | 加水溶解、蒸发 |
| C | 除去氯化钾溶液中的碳酸钾 | 加入适量的稀硫酸 |
| D | 除去氯化钙溶液中的盐酸 | 加入过量的碳酸钙、过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.下列物质的用途主要由化学性质决定的是( )
| A. | 活性炭用作吸附剂 | B. | 干冰用于人工降雨 | ||
| C. | 肥皂水用于区别硬水和软水 | D. | 液态氮作制冷剂 |
18.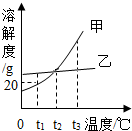 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )
 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )| A. | 甲物质的溶解度随温度的升高而增大 | |
| B. | t1℃时,甲的饱和溶液中溶质和溶剂的质量比为1:5 | |
| C. | t2℃时,甲、乙两物质的溶解度相等 | |
| D. | 将t3℃时甲、乙两物质的饱和溶液降温到t1℃,甲析出的晶体多 |
7.下列关于镁原子、镁离子叙述正确的是( )
| A. | 它们都显电性 | |
| B. | 它们原子核外电子数目相等 | |
| C. | 它们属于同种元素 | |
| D. | 镁离子是镁原子得到2个电子形成的 |
8.氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)氨气易与酸反应.
【设计实验】
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
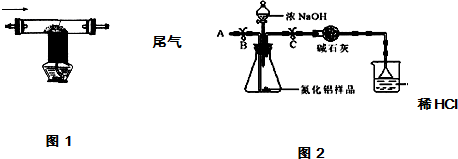
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
【实验讨论】
(1)步骤①加入样品前还应检查装置气密性.
(2)装有碱石灰的干燥管作用是除去气体中的水;装置中使用漏斗的目的是防止液体倒吸.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是浓盐酸具有挥发性;
(4)步骤④的目的是使反应产生的氨气充分吸收.
【实验结论】
所制氮化铝样品中氮化铝的质量分数为90%
【事故处理】
实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
【拓展探究】
(1)实验后剩余的浓NaOH溶液不能(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液20g.
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)氨气易与酸反应.
【设计实验】
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g

⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
【实验讨论】
(1)步骤①加入样品前还应检查装置气密性.
(2)装有碱石灰的干燥管作用是除去气体中的水;装置中使用漏斗的目的是防止液体倒吸.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是浓盐酸具有挥发性;
(4)步骤④的目的是使反应产生的氨气充分吸收.
【实验结论】
所制氮化铝样品中氮化铝的质量分数为90%
【事故处理】
实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
【拓展探究】
(1)实验后剩余的浓NaOH溶液不能(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液20g.