题目内容
18.按要求写出下列反应的文字表达式(1)硫在氧气中燃烧硫+氧气$\stackrel{点燃}{→}$二氧化硫
(2)碳酸分解碳酸→水+二氧化碳
(3)实验室制取二氧化碳碳酸钙+稀盐酸→氯化钙+水+二氧化碳
(4)氢气在空气中燃烧氢气+氧气$\stackrel{点燃}{→}$水.
分析 硫燃烧生成二氧化硫;
碳酸分解生成水和二氧化碳;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
氢气燃烧生成水.
解答 解:(1)硫在氧气中燃烧的文字表达式为:硫+氧气$\stackrel{点燃}{→}$二氧化硫;
(2)碳酸分解的文字表达式为:碳酸→水+二氧化碳;
(3)实验室制取二氧化碳的文字表达式为:碳酸钙+稀盐酸→氯化钙+水+二氧化碳;
(4)氢气在空气中燃烧的文字表达式为:氢气+氧气$\stackrel{点燃}{→}$水.
故填:硫+氧气$\stackrel{点燃}{→}$二氧化硫;碳酸→水+二氧化碳;碳酸钙+稀盐酸→氯化钙+水+二氧化碳; 氢气+氧气$\stackrel{点燃}{→}$水.
点评 书写反应的文字表达式时,反应物、生成物、反应条件要正确,要注意不能出现错别字.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
8.氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)氨气易与酸反应.
【设计实验】
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
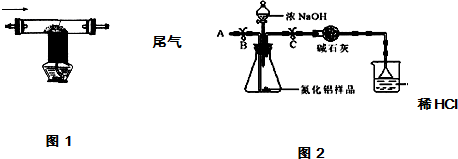
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
【实验讨论】
(1)步骤①加入样品前还应检查装置气密性.
(2)装有碱石灰的干燥管作用是除去气体中的水;装置中使用漏斗的目的是防止液体倒吸.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是浓盐酸具有挥发性;
(4)步骤④的目的是使反应产生的氨气充分吸收.
【实验结论】
所制氮化铝样品中氮化铝的质量分数为90%
【事故处理】
实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
【拓展探究】
(1)实验后剩余的浓NaOH溶液不能(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液20g.
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)氨气易与酸反应.
【设计实验】
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 |
| 1除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO; |
| 2用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3 $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO. |
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g

⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
【实验讨论】
(1)步骤①加入样品前还应检查装置气密性.
(2)装有碱石灰的干燥管作用是除去气体中的水;装置中使用漏斗的目的是防止液体倒吸.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是浓盐酸具有挥发性;
(4)步骤④的目的是使反应产生的氨气充分吸收.
【实验结论】
所制氮化铝样品中氮化铝的质量分数为90%
【事故处理】
实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:立即用稀醋酸中和,然后用水冲洗,再用抹布擦干.
【拓展探究】
(1)实验后剩余的浓NaOH溶液不能(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式2NaOH+CO2═Na2CO3+H2O.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液20g.
9.为了警示世人因气候变化对人类危害的关注,2009年“世界环境日”的主题是:“团结起来应对气候变化”.下列做法或认识不符合这-主题的是( )
| A. | 提倡乘坐公共交通、骑自行车或步行的方式出行 | |
| B. | 在生产和生活活动中提倡使用节能技术和节能用具 | |
| C. | 植树造林,严禁乱砍滥伐 | |
| D. | 焚烧废旧塑料袋 |
13.水是我们生活、生产各方面都离不开的重要物质,下列有关水的说法正确的是( )
| A. | 海水、湖水是混合物 | B. | 电解是一种常用的净水方法 | ||
| C. | 过滤能除去水中所有杂质 | D. | 水的污染会引起土壤污染 |
3.研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探
究的主要过程:
假设:H2O2生成O2的快慢与催化剂的种类有关.
实验方案:常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶
(相同体积)O2所需要的时间.
实验记录:
实验结论:在相同条件下,H2O2生成O2的快慢与催化剂种类有关
反思:H2O2生成O2 的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
假设:H2O2生成氧气的快慢与过氧化氢的浓度有关
实验方案:在同温下,取二份质量相等的不同浓度的H2O2溶液,分别加入质量相等的同种催化剂,测量各收集一瓶气体所需的时间.
究的主要过程:
假设:H2O2生成O2的快慢与催化剂的种类有关.
实验方案:常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶
(相同体积)O2所需要的时间.
实验记录:
| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2 | 6% H2O2 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 时间 | 152s | 35s |
反思:H2O2生成O2 的快慢还与哪些因素有关?请你帮助他们继续探究.(只要求提出假设和实验方案)
假设:H2O2生成氧气的快慢与过氧化氢的浓度有关
实验方案:在同温下,取二份质量相等的不同浓度的H2O2溶液,分别加入质量相等的同种催化剂,测量各收集一瓶气体所需的时间.
7.下列实验方案设计中,可行的是( )
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质 |