题目内容
3.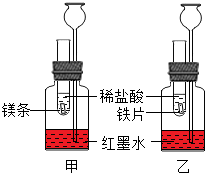 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.(1)该实验的目的是比较镁、铁与稀盐酸反应的剧烈程度以及相同时间内镁、铁与稀盐酸反应放出热量的多少.反应过程中观察到甲装置中长颈漏斗内液面高于乙装置中长颈漏斗内液面,则放热较多的是镁和稀盐酸的反应.
(2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量相等(填“多”、“少”或“相等”).
(3)反应过程中,下列现象能比较金属镁与铁金属活动性强弱的是:A.
A.金属与稀盐酸反应的剧烈程度
B.试管中产生气泡的多少
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案.
A:称取一定质量的样品$→_{搅拌}^{加入足量的稀盐酸}$过滤、洗涤、干燥、称量所得固体质量
B:称取一定质量的样品$→_{搅拌}^{加入足量的硫酸铜溶液}$过滤、洗涤、干燥、称量所得固体质量
(1)两种方案,你认为不能达到目的是B(填“A”或“B”),理由是所得固体质量是反应生成的铜和样品中铜的质量之和,无法计算铁或反应生成铜的质量.
(2)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数偏小(填“偏大”、“偏小”、“不变”或“无法判断”).
分析 探究活动一:
(1)反应放热越多,温度升高越快,瓶内气压增大越明显,导致装置中长颈漏斗内液面上升越快;
(2)若实验所用的金属均过量,则生成氢气质量决定于稀盐酸;
(3)金属与稀盐酸反应越剧烈,说明金属越活泼;
探究活动二:
铁和稀盐酸反应生成氯化亚铁和氢气,和硫酸铜反应生成硫酸亚铁和铜;
加热条件下,铜能和空气中的氧气反应生成氧化铜.
解答 解:探究活动一:
(1)反应过程中观察到甲装置中长颈漏斗内液面高于乙装置中长颈漏斗内液面,则放热较多的是镁和稀盐酸的反应.
故填:镁和稀盐酸的反应.
(2)若实验所用的金属均过量,则生成氢气质量决定于稀盐酸,由于加入两支试管中的稀盐酸的质量和质量分数均相等,则甲装置中产生的H2比乙装置中产生的H2质量相等.
故填:相等.
(3)金属与稀盐酸反应越剧烈,说明金属越活泼,因此根据金属与稀盐酸反应的剧烈程度可以比较金属活动性顺序.
故填:A.
探究活动二:
(1)两种方案,不能达到目的是B,理由是所得固体质量是反应生成的铜和样品中铜的质量之和,无法计算铁或反应生成铜的质量.
故填:B;所得固体质量是反应生成的铜和样品中铜的质量之和,无法计算铁或反应生成铜的质量.
(2)A方案中,所得固体质量是铜的质量,根据铜的质量和样品质量可以计算铁的质量,进一步可以计算铁的质量分数;
若采用加热烘干的方式干燥滤渣,则铜能和空气中的氧气反应生成氧化铜,导致铜的质量偏大,从而会导致测定的铁的质量分数偏小.
故填:偏小.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.化学科代表和小明同学帮助老师整理化学药品时,他们发现分别放在两个试剂瓶中的两片用砂纸磨得磨得光亮的银白色金属,未贴标签.它们可能是哪两种金属?它们的金属活动性谁强?两位同学想对这两种金属X和Y的金属活动性顺序进行实验探究.
(1)进行猜想:①科代表猜想:活动性X大于Y.②小明同学猜想:X小于Y
(2)探究实验:请你完成实验报告的空白内容
(3)若X、Y分别是银、铁中的各一种,则根据实验结果说明Y是银.
(1)进行猜想:①科代表猜想:活动性X大于Y.②小明同学猜想:X小于Y
(2)探究实验:请你完成实验报告的空白内容
| 实验步骤 | 实验现象 | 结论 |
| 将金属X和Y分别放入稀盐酸中 | 金属Y表面无明显变化,金属X的表面有气泡冒出.将燃着的木条放在装金属X的试管口,气体燃烧 | 科代表同学猜想是正确的 |
11. 某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )
某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )
 某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )
某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )| A. | 一定有碳、氢、氧元素 | B. | 一定有碳、氢元素,可能有氧元素 | ||
| C. | 一定有碳元素,可能有氢、氧元素 | D. | 一定有碳、氧元素,可能有氢元素 |
8.某化学兴趣小组的同学要探究铝、铁、铜三种金属的活动性顺序,请你参与探究并填写空格.
【实验探究】同学们将粗细相同的、打磨过的铝丝和铁丝分别插入硫酸亚铁溶液、硫酸铜溶液中:
写出铝与硫酸铜溶液反应的化学方程式2Al+3CuSO4=Al2(SO4)3+3Cu.
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙(选填“甲”、“乙”或“丙”)试管的实验时多余的.
(2)洁洁认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.他设计了两种插入顺序,请你补全顺序二:
顺序一:Cu Fe Al;顺序二:Fe Cu Al.
洁洁按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(用化学方程式表示).
【拓展迁移】为了回收金属,同学们将甲、乙、丙三支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液.向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜.
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝.
【实验探究】同学们将粗细相同的、打磨过的铝丝和铁丝分别插入硫酸亚铁溶液、硫酸铜溶液中:
| 操作 |  甲 | 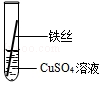 乙 乙 | 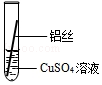 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙(选填“甲”、“乙”或“丙”)试管的实验时多余的.
(2)洁洁认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.他设计了两种插入顺序,请你补全顺序二:
顺序一:Cu Fe Al;顺序二:Fe Cu Al.
洁洁按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(用化学方程式表示).
【拓展迁移】为了回收金属,同学们将甲、乙、丙三支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液.向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜.
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝.
15.人类生存需要清新的空气,下列情况不会造成空气污染的是( )
| A. | 使用太阳能热水器 | B. | 燃放烟花 | ||
| C. | 光合作用 | D. | 汽车尾气 |
13.某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液.实验后废液分别集中到各组的一个废液缸中.研究小组对两个组的废液进行检测,结果如下表.下列说法错误的是(不考虑酚酞和水)( )
| 废液来源 | 甲组 | 乙组 |
| 检测方法与结果 | 观察废液呈无色 | 观察废液呈红色 |
| A. | 甲组废液中可能含有稀盐酸和稀硫酸 | |
| B. | 乙组废液中一定含有氢氧化钠 | |
| C. | 直接将甲组的废液排入铸铁管下水道,可能腐蚀铸铁水管 | |
| D. | 乙组呈红色是因为氢氧化钠溶液遇到酚酞试液会变红色 |
 超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:
超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题: