题目内容
8.某化学兴趣小组的同学要探究铝、铁、铜三种金属的活动性顺序,请你参与探究并填写空格.【实验探究】同学们将粗细相同的、打磨过的铝丝和铁丝分别插入硫酸亚铁溶液、硫酸铜溶液中:
| 操作 |  甲 | 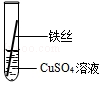 乙 乙 | 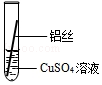 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙(选填“甲”、“乙”或“丙”)试管的实验时多余的.
(2)洁洁认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.他设计了两种插入顺序,请你补全顺序二:
顺序一:Cu Fe Al;顺序二:Fe Cu Al.
洁洁按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(用化学方程式表示).
【拓展迁移】为了回收金属,同学们将甲、乙、丙三支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液.向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜.
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝.
分析 铝比铁活泼,铁比铜活泼,铝能和硫酸铜反应生成硫酸铝和铜;
铁锈主要成分是氧化铁,能和稀硫酸反应生成硫酸铁和水,铁能和稀硫酸反应生成硫酸亚铁和氢气,铝能和稀硫酸反应生成硫酸铝和氢气.
解答 解:【实验探究】
实验过程如下表所示:
| 操作 | 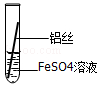 甲 |  乙 乙 |  丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
故填:2Al+3CuSO4=Al2(SO4)3+3Cu.
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙试管的实验时多余的,这是因为通过甲、乙试管中的实验现象可以判断三种金属活动性顺序.
故填:丙.
(2)顺序一:Cu Fe Al,加入铜时无明显现象,加入铁时,和稀硫酸反应生成硫酸亚铁和氢气,说明铁比铜活泼,加入铝时,铝表面附着一层固体,说明铝比铁活泼;
顺序二:Fe Cu Al,加入铁时,和稀硫酸反应生成硫酸亚铁和氢气,加入铜时无明显现象,说明铁比铜活泼,加入铝时,铝表面附着一层固体,说明铝比铁活泼;
按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,可能的原因是铁表面有铁锈,铁锈中的氧化铁和稀硫酸反应生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
故填:Fe Cu Al;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
【拓展迁移】
向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜,这是因为铜不能和稀硫酸反应;
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝,这是因为铝比铁活泼,溶液中的亚铁离子能被铝还原出来,因此稀硫酸反应生成气体的物质中一定含有铁,可能含有铝.
故填:铜;铜、铁;铝.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
19.如果植株生长得特别矮小,而且叶片呈暗绿色甚至紫色,是由于缺少哪种无机盐( )
| A. | 氮 | B. | 磷 | C. | 钾 | D. | 铁 |
16.从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是( )
| A. | 通电使水分解 | B. | 高锰酸钾受热分解 | ||
| C. | 氯酸钾加热分解 | D. | 过氧化氢分解 |
13.金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关.下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究.
【实验记录】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中.
【实验记录】用“√”表示能观察到实验现象,用“-”表示观察不到实验现象(见右表).
实验现象记录表
(1)通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是镁能够在空气中燃烧
(2)运用“控制变量法”设计实验方案是化学研究的重要方法.步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是温度.写出镁和稀硫酸反应的化学方程式Mg+H2SO4═MgSO4+H2↑,此反应属于置换反应(填基本反应类型).
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是Mg>Fe>Cu(用元素符号表示)
【实验记录】测定金属铁、铜和镁的活动性强弱
【所用试剂】稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中.
【实验记录】用“√”表示能观察到实验现象,用“-”表示观察不到实验现象(见右表).
实验现象记录表
| 金属 | 空气 | 稀硫酸 | 硝酸银溶液 |
| 铁 | - | √ | √ |
| 铜 | - | - | √ |
| 镁 | √ | √ | √ |
(2)运用“控制变量法”设计实验方案是化学研究的重要方法.步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是温度.写出镁和稀硫酸反应的化学方程式Mg+H2SO4═MgSO4+H2↑,此反应属于置换反应(填基本反应类型).
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是Mg>Fe>Cu(用元素符号表示)
17.某温度下,有一接近饱和的硝酸钾溶液,欲使其变为饱和溶液,采取的措施不当的是( )
| A. | 倒去部分硝酸钾溶液 | B. | 恒温蒸发掉一部分水 | ||
| C. | 降低溶液的温度 | D. | 加入硝酸钾晶体 |
18.根据氯化钠和硝酸钾的溶解度表,回答下列问题:
(1)写出硝酸钾和氯化钠具有相同溶解度时的温度范围:20~40℃(限表中相邻两个温度之间)
(2)在60℃时,向50g水中加入60g 硝酸钾,充分搅拌后所得溶液质量为92.75g
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量4g.
| 名称 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
| 氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g | 37.0g | 37.3g | 37.8g |
| 硝酸钾 | 20.9g | 31.6g | 45.8g | 63.9g | 85.5g | 110g | 138g |
(2)在60℃时,向50g水中加入60g 硝酸钾,充分搅拌后所得溶液质量为92.75g
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量4g.
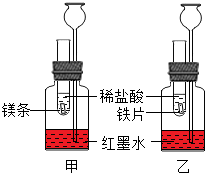 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.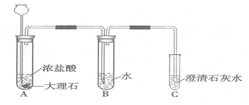 已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:
已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题: