题目内容
18.将下列化学方程式配平(1)8Al+3Fe3O4═9Fe+4Al2O3
(2)4NH3+5O2═4NO+6H2O.
分析 根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可;配平时要注意化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数.
解答 解:(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe3O4、Al2O3前面的化学计量数分别为:3、4,最后调整四氧化三铁、氧化铝前面的化学计量数为8、9.
(2)本题可利用“定一法”进行配平,把NH3的化学计量数定为1,则O2、NO、H2O前面的化学计量数分别为:1、$\frac{5}{4}$、$\frac{3}{2}$,同时扩大4倍,则NH3、O2、NO、H2O前面的化学计量数分别为:4、5、4、6.
故答案为:(1)8、3、9、4;(2)4、5、4、6.
点评 本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数.

练习册系列答案
相关题目
9.某学生用量筒量取液体的体积,量筒放平且面对刻度线,先仰视凹液面的最低点读数为19mL;倾出部分液体后,俯视液体凹液面的最低处读数为10mL,则实际该学生倾出液体的体积( )
| A. | 等于9mL | B. | 大于9mL | C. | 小于9mL | D. | 无法判断 |
13.双氧水制取氧气时,忘记加入二氧化锰,其结果是( )
| A. | 不放出氧气 | B. | 放出氧气的速度慢 | ||
| C. | 放出氧气总量会减少 | D. | 放出氧气总量会减少且速度慢 |
10.某课外兴趣小组的同学为了探究金属X、Y、Z三种金属的活动性顺序,进行实验进行了如下探究,请你加入他们一起完成探究:
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式2Z+3H2SO4═Z2(SO4)3+3H2↑(金属就用Z表示);
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
(2)通过实验二并结合实验一的现象分析,可得出X、Y、Z金属活动性由强到弱的顺序为:Z>X>Y.
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
(3)实验⑦和⑧表明:该反应快慢与温度有关;
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
| 实验序号 | ① | ② | ③ |
| 实验步骤 | 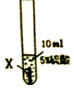 | 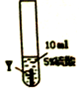 | 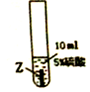 |
| 实验现象 | 在X片表面无明显变化 | Y片表面无明显变化 | Z片溶解,表面有无色氢气产生,溶液最终无色 |
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
| 实验序号 | ④ | ⑤ |
| 实验步骤 | 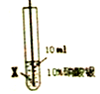 |  |
| 实验现象 | 在X丝表面有银白色的固体析出 | 在Y丝表面没有明显现象 |
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
7.实验室许多药品需要密封保存.下列药品需要密封保存原因解释错误的是( )
| A. | 浓盐酸,防止挥发 | B. | NaOH固体,防止潮解和与CO2反应 | ||
| C. | 浓硫酸,防止吸水 | D. | 生石灰,防止与氧气反应 |
8. 化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
 化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )
化学反应的基本类型有四种(化合、分解、置换和复分解反应),其中,化学反应前后有元素化合价发生改变的反应属于氧化还原反应,他们的关系如图所示.下列反应中只属于阴影“3”处的化学反应是( )| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | NaHCO3+HCl=NaCl+H2O+CO2↑ | D. | Fe+CuSO4=FeSO4+Cu |
 以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,例如E点可表示+2价的亚铁盐.请回答:
以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,例如E点可表示+2价的亚铁盐.请回答: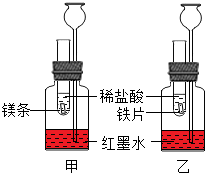 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.