题目内容
13. 超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:
超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的纯碱样品中碳酸钠的质量分数.他们取了5g该纯碱样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙的质量与产生沉淀的质量关系如图所示.请回答下列问题:(1)该纯碱样品中碳酸钠的质量分数是多少?(写出计算步骤,计算结果精确到0.1%)
(2)至恰好完全反应时,所得不饱和溶液中溶质的质量分数为5.4%(计算结果精确到0.1%)
(3)如果反应开始前,向烧杯中滴加几滴酚酞溶液,在整个测定过程中可观察到的现象是:产生沉淀,溶液由红色变成无色.
分析 碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)设碳酸钠质量为x,反应生成碳酸钙质量为y,生成氯化钠质量为z,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 111 100 117
x 44.4g×10% y z
$\frac{106}{x}$=$\frac{111}{44.4g×10%}$=$\frac{100}{y}$=$\frac{117}{z}$,
x=4.24g,y=4g,z=4.68g,
该纯碱样品中碳酸钠的质量分数是:$\frac{4.24g}{5g}$×100%=84.8%,
答:该纯碱样品中碳酸钠的质量分数是84.8%.
(2)至恰好完全反应时,所得不饱和溶液质量为:60g+44.4g-4g=100.4g,
至恰好完全反应时,所得不饱和溶液中溶质的质量分数为:$\frac{5g-4.24g+4.68g}{100.4g}$×100%=5.4%,
故填:5.4%.
(3)反应开始前,向烧杯中滴加几滴酚酞溶液时,由于溶液显碱性,因此溶液变红色,随着反应进行,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,当恰好完全反应时溶液显中性,溶液变成无色,因此在整个测定过程中可观察到的现象是产生沉淀,溶液由红色变成无色.
故填:产生沉淀,溶液由红色变成无色.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
1.Zn粉与碘晶体混合后看不到明显变化,但当滴入少量水后,则立即剧烈反应,那么在此反应中水的作用是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 还原产物 | D. | 催化剂 |
5. 化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如图所示.
化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如图所示.
【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】(1)溶液的pH是由H+或OH-浓度决定,H+浓度越大,
pH越小;OH-浓度越大,pH越大.
(2)溶液中某种离子浓度非常小时,可忽略不计.
【作出猜想】猜想①:溶液pH变化是因为氢氧化钠溶液被稀释.
猜想②:溶液pH变化是因为发生了化学反应.
【进行实验】同学们分成两组分别进行实验.
甲组:同学们将4mL2%的稀硫酸换成4mL水,逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理.
乙组:同学们分别取a、b、c三处溶液进行实验.
【实验结论】猜想Ⅱ合理.
【知识拓展】从微观角度分析,中和反应的实质是H+和OH-反应变成H2O.
 化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如图所示.
化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如图所示.【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】(1)溶液的pH是由H+或OH-浓度决定,H+浓度越大,
pH越小;OH-浓度越大,pH越大.
(2)溶液中某种离子浓度非常小时,可忽略不计.
【作出猜想】猜想①:溶液pH变化是因为氢氧化钠溶液被稀释.
猜想②:溶液pH变化是因为发生了化学反应.
【进行实验】同学们分成两组分别进行实验.
甲组:同学们将4mL2%的稀硫酸换成4mL水,逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理.
乙组:同学们分别取a、b、c三处溶液进行实验.
| 实验操作 | 实验现象 | 实验分析 |
| 取适量a处溶液于试管中,加入镁条 | 无气泡产生 | 溶液中几乎不含H+(填离子符号) |
| 取适量b处溶液于试管中,加入紫色石蕊溶液 | 石蕊溶液不变色 | 溶液中几乎不含H+和OH- |
| 取适量c处溶液于试管中,加入硫酸铜溶液 | 无沉淀产生 | 溶液中几乎不含OH- |
【知识拓展】从微观角度分析,中和反应的实质是H+和OH-反应变成H2O.
2. 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )| A. | 水是由氢气和氧气组成的 | |
| B. | 试管b中所得气体能燃烧 | |
| C. | 试管a、b中所得气体的质量比约为2:1 | |
| D. | 试管a、b中所得气体的体积比约为2:1 |

 以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,例如E点可表示+2价的亚铁盐.请回答:
以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,例如E点可表示+2价的亚铁盐.请回答: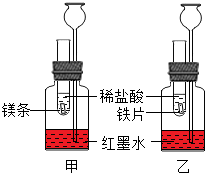 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.