题目内容
11. 某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )
某物质由碳、氢、氧三种元素中的一种或几种组成,将该物质在空气中燃烧后的产物依次通过澄清石灰水和无水硫酸铜,观察到石灰水变浑浊,无水硫酸铜变成蓝色.有关该物质的组成,推断正确的是( )| A. | 一定有碳、氢、氧元素 | B. | 一定有碳、氢元素,可能有氧元素 | ||
| C. | 一定有碳元素,可能有氢、氧元素 | D. | 一定有碳、氧元素,可能有氢元素 |
分析 根据二氧化碳能使澄清的石灰水变浑,以及白色的无水硫酸铜与水反应变成蓝色的五水硫酸铜的性质判断.
解答 解:二氧化碳能使澄清的石灰水变浑,将该物质燃烧后的产物先通过澄清石灰水,观察到石灰水变浑浊,说明燃烧生成了二氧化碳;白色的无水硫酸铜与水反应变成蓝色的五水硫酸铜,将该物质燃烧后的产物先通过的石灰水,后通过无水硫酸铜,无水硫酸铜变成蓝色,但是由于气体是从澄清石灰水中出来的,所以水可能完全来自于石灰水,也可能原生成物中有水生成.所以一定含有碳元素,对氢元素和氧元素不能下结论.
故选C.
点评 物质的推断是初中化学的难重点,也是中考的热点之一,了解物质的性质是解题的前提条件,解题时还要注意前后步骤间的联系,充分利用综合归纳法得出完整合理的结论.

练习册系列答案
相关题目
1.Zn粉与碘晶体混合后看不到明显变化,但当滴入少量水后,则立即剧烈反应,那么在此反应中水的作用是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 还原产物 | D. | 催化剂 |
2. 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
 根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可以从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )| A. | 水是由氢气和氧气组成的 | |
| B. | 试管b中所得气体能燃烧 | |
| C. | 试管a、b中所得气体的质量比约为2:1 | |
| D. | 试管a、b中所得气体的体积比约为2:1 |
19.如果植株生长得特别矮小,而且叶片呈暗绿色甚至紫色,是由于缺少哪种无机盐( )
| A. | 氮 | B. | 磷 | C. | 钾 | D. | 铁 |
16.从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是( )
| A. | 通电使水分解 | B. | 高锰酸钾受热分解 | ||
| C. | 氯酸钾加热分解 | D. | 过氧化氢分解 |
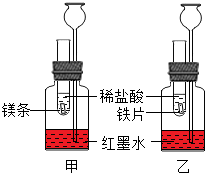 探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.
探究活动一:在室温条件下进行如图所示实验.已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.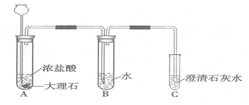 已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题:
已知盐酸是HCl气体溶于水所形成的溶液.在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象.回答下列问题: