题目内容
6. 对比实验是科学探究运用最多的方法之一,下列是几个对比试验:
对比实验是科学探究运用最多的方法之一,下列是几个对比试验:| 序号 | 实验1 | 实验2 | 实验3 |
| 实验目的 | 比较氯气和空气的部分物理性质 | 二氧化碳的化学性质比较 | |
| 实验装置图 | 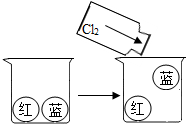 |  |  |
(1)氯气是重要的化工原料,也是一种毒气,为认识氯气的物理性质,在“实验1”中,红色气球充满氯气,蓝色气球充满空气,开始时两只气球都沉在杯底,当把氯气缓慢注入烧杯中时,发现蓝色气球逐渐浮起,用手轻按,松手后气球又上浮.
①氯气的物理性质是密度比空气大;
②若遇氯气泄漏,引导他人逃生是我们的责任,请提出你的引导方向:地势较高的地方;
(2)根据“实验2”提供的图示素材:
①该实验的目的是:比较接触面积对化学反应速率的影响,实验中,对盐酸提出的条件是相同质量,相同质量分数;
②装置中红墨水的作用是便于及时发现气泡的产生;
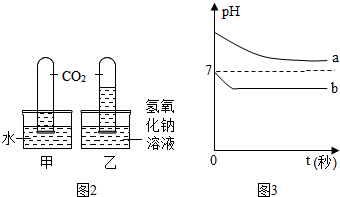
(3)①“实验3”方案设计的原理依据是二氧化碳与水、氢氧化钠反应,导致试管内压强减小,依据水面上升高度的不同,验证氢氧化钠会与二氧化碳发生反应,如果图示为实验结果,从中获得的结论是氢氧化钠会与二氧化碳反应;
②写出甲装置试管中发生反应的化学方程式H2O+CO2=H2CO3;
③实验中,用传感器获得甲、乙两试管上层溶液的pH,并绘制成pH随时间的变化曲线如图2所示,曲线a反映的是装置乙(填“甲”或“乙”)的pH变化,该曲线会否与pH=7的虚线相交?不会,理由是二氧化碳和氢氧化钠反应生成的碳酸钠显碱性.
分析 (1)①根据物理性质是不需要发生化学变化就表现出来的性质,常表现为颜色、状态、气味、密度等进行分析;
②根据氯气的密度比空气大进行分析;
(2)①根据碳酸钙粉末、块状碳酸钙和盐酸的接触面积不同,以及控制变量法的具体操作进行分析;
②根据红墨水可以及时的发现气泡的产生进行分析;
(3)①根据水与二氧化碳反应,氢氧化钠溶液于二氧化碳反应后试管内的压强不同进行分析;
②根据水和二氧化碳反应生成碳酸进行分析;
③根据水和二氧化碳反应生成碳酸,溶液的pH值从7开始逐渐减小,氢氧化钠和二氧化碳反应生成碳酸钠和水,pH值从大于7的某个位置逐渐减小,碳酸钠溶液显碱性,所以溶液的曲线永远不会与pH=7的线相交进行分析.
解答 解:(1)①物理性质是不需要发生化学变化就表现出来的性质,常表现为颜色、状态、气味、密度等,所以通过分析可知,氯气的物理性质是:密度比空气大;
②氯气的密度比空气大,所以若遇氯气泄漏,引导他人逃生的方向是:地势较高的地方;
(2)①碳酸钙粉末、块状碳酸钙和盐酸的接触面积不同,以及控制变量法的具体操作,所以该实验的目的是:比较接触面积对化学反应速率的影响,实验中,对盐酸提出的条件是:相同质量,相同质量分数;
②红墨水可以及时的发现气泡的产生;
(3)①“实验3”方案设计的原理依据是:二氧化碳与水、氢氧化钠反应,导致试管内压强减小,依据水面上升高度的不同,验证氢氧化钠会与二氧化碳发生反应,如果图示为实验结果,从中获得的结论是:氢氧化钠会与二氧化碳反应;
②水和二氧化碳反应生成碳酸,化学方程式为:H2O+CO2=H2CO3;
③水和二氧化碳反应生成碳酸,溶液的pH值从7开始逐渐减小,氢氧化钠和二氧化碳反应生成碳酸钠和水,pH值从大于7的某个位置逐渐减小,碳酸钠溶液显碱性,所以溶液的曲线永远不会与pH=7的线相交,所以曲线a反映的是装置乙的pH变化.
故答案为:(1)①密度比空气大;
②地势较高的地方;
(2)①比较接触面积对化学反应速率的影响,相同质量,相同质量分数;
②便于及时发现气泡的产生;
(3)①二氧化碳与水、氢氧化钠反应,导致试管内压强减小,依据水面上升高度的不同,验证氢氧化钠会与二氧化碳发生反应,氢氧化钠会与二氧化碳反应;
②H2O+CO2=H2CO3;
③乙,不会,二氧化碳和氢氧化钠反应生成的碳酸钠显碱性.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的提示进行解答.

| A.化学概念中的“不一定” | B.化学与生活 |
| ①碱的水溶液通常呈碱性,但碱性溶液不一定是碱的溶液 ②单质由同种元素组成,但同种元素组成的物质不一定是单质 ③酸碱中和反应生成盐和水,但生成盐和水的反应不一定是中和反应 | ①除去餐具油污-用洗洁精乳化 ②除去家庭水壶里的水垢-用食醋浸泡 ③除去铝壶表面的污迹-用钢丝球擦拭 |
| C.化学实验数据记录 | D.化学中常见的“三” |
| ①用10mL量筒量取7.25mL水 ②用pH试纸测得苹果汁的pH为3.2 ③用托盘天平称取5.6g铁粉 | ①煤、石油、天然气-三大化石燃料 ②合金、合成纤维、合成橡胶-三大合成材料 ③分子、原子、离子-构成物质的三种粒子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 石蜡固体颗粒 | B. | 氧气 | C. | 二氧化碳 | D. | 水蒸气 |
| A. | CaCO3的摩尔质量为98 | |
| B. | 氯化铁的化学式为FeCl2 | |
| C. | 500mL 0.2mol•L-1 BaCl2溶液中Cl-离子浓度为0.4mol•L-1 | |
| D. | Cu+2FeCl3═CuCl2+2FeCl2是置换反应 |
| A. | m/12n | B. | mn/12 | C. | 12n/m | D. | m/n |