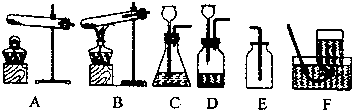题目内容
12. 通过对化学的学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究的方法.
通过对化学的学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究的方法.实验一、探究分子在不断运动(如图)
实验现象:B烧杯中的无色酚酞溶液变红.
该实验的探究方法是:对看不见、摸不着的粒子,要“观察”它的运动可设计实验,通过宏观的现象来间接认识.
实验二、探究二氧化碳与水的反应(取四朵用紫色石蕊溶液染成紫色的干燥的小花,进行如图所示实验)

实验现象:(Ⅰ)、(Ⅳ)中的小花变红.
设计(Ⅱ)、(Ⅲ)实验的目的是:验证水和二氧化碳分别是否能使紫色石蕊变色.
该实验的探究方法是:设计分析B(填“A”或“B”或“C”),获得结论.
A.仅一个单因素的实验
B.有多种因素的对比实验
C.用前面实验的生成物继续实验
实验三、验证二氧化碳与氢氧化钠溶液确实发生了反应(完成下列表格)(提示:含有碳酸根的物质遇到稀盐酸会放出二氧化碳气体,氢氧化钠溶液与氢氧化钙溶液的性质相似)
| 方案 | 实验步骤 | 实验现象 |
| 1 | 取两个等体积的软塑料瓶,充满二氧化碳,然后分别加入蒸馏水和氢氧化钠溶液,盖紧瓶塞,再加入等体积的蒸馏水和氢氧化钠溶液,盖紧瓶塞,震荡. | 加入氢氧化钠溶液的软塑料瓶比加入蒸馏水的软塑料瓶变得更瘪 |
| 2 | 先将二氧化碳通入盛有足量氢氧化钠溶液的试管 中,然后加入足量的盐酸. | 冒气泡 |
我认为方案1的探究方法是通过密闭容器内气体压强变化程度的对比来判断反应的发生,
方案2的探究方法是通过验证生成物的存在来判断反应的发生.
小结:上述三个实验告诉我们:当某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应.
分析 实验一:浓氨水易挥发,氨气溶于水其溶液为碱性;
实验二:设计(Ⅱ)、(Ⅲ)实验的目的是:作对照组,验证水和二氧化碳分别是否能使紫色石蕊变色;
实验三:验证二氧化碳与氢氧化钠溶液确实发生了反应,1.分别加入蒸馏水和氢氧化钠溶液,作对照实验;
2.加入足量的稀盐酸,观察是否有气泡产生.
解答 解:实验一:浓氨水易挥发,氨气溶于水其溶液为碱性,则实验现象:B烧杯中的无色酚酞溶液变红;
实验二:第一、四朵花变色,而设计(Ⅱ)、(Ⅲ)实验的目的是:作对照组,验证水和二氧化碳分别是否能使紫色石蕊变色;该实验的探究方法是:设计分析B.有多种因素的对比实验获得结论;
实验三:验证二氧化碳与氢氧化钠溶液确实发生了反应(实验如下表所示)
| 1 | 加入等体积的蒸馏水和氢氧化钠溶液,盖紧瓶塞,震荡. | 加入氢氧化钠溶液的软塑料瓶比加入蒸馏水的软塑料瓶变得更瘪 |
| 2 | 加入足量的盐酸(或氯化钡溶液或澄清石灰水或氯化钙溶液或硝酸钡溶液) | 冒气泡(或有白色沉淀生成…) |
故答案为:实验一:B烧杯中的无色酚酞溶液变红
实验二:验证水和二氧化碳分别是否能使紫色石蕊变色B
实验三:
| 1 | 加入等体积的蒸馏水和氢氧化钠溶液,盖紧瓶塞,震荡. | 加入氢氧化钠溶液的软塑料瓶比加入蒸馏水的软塑料瓶变得更瘪 |
| 2 | 加入足量的盐酸(或氯化钡溶液或澄清石灰水或氯化钙溶液或硝酸钡溶液) | 冒气泡(或有白色沉淀生成…) |
【说明:所写步骤、现象要匹配,所写化学方程式要与上述方案相关.其它答案合理均可】
方案1:通过密闭容器内气体压强变化程度的对比来判断反应的发生(或通过反应物量的减少来判断反应的发生.)
方案2:通过验证生成物的存在来判断反应的发生.
点评 通过宏观的现象来间接认识分子、原子的运动;对于某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应.

练习册系列答案
相关题目
3.下列关于S、S2-两种粒子的判断中,正确的是( )
①质子数相等 ②核外电子数相等 ③电子层数相同
④质量几乎相等 ⑤最外层电子数相等 ⑥S2-比S稳定.
①质子数相等 ②核外电子数相等 ③电子层数相同
④质量几乎相等 ⑤最外层电子数相等 ⑥S2-比S稳定.
| A. | ①④⑤ | B. | ①④⑥ | C. | ①③④⑥. | D. | ②③④ |
17.若两种不同的物质相互混合不发生反应,我们常称这两种物质能共存.下列各组物质在溶液中能够共存的是( )
| A. | 盐酸和硝酸银 | B. | 硫酸和硝酸钡 | C. | 盐酸和氯化钡 | D. | 铁和稀盐酸 |
4.下列与水有关的说法正确的是( )
| A. | 水能溶解所有的物质 | |
| B. | 通过活性炭吸附可将海水淡化 | |
| C. | 电解水正极和负极收集到气体的体积比为2:1 | |
| D. | 用肥皂水可区分硬水和软水 |
1.除去下列物质中的杂质所选用的试剂及操作方法不正确的一组是( )
| 物 质 | 所含杂质 | 除 去 杂 质 的 方 法 | |
| A | KOH溶液 | (K2CO3) | Ca(OH)2溶液、过滤 |
| B | N2气体 | (O2) | 将气体缓缓通过灼热的铜网 |
| C | CuO | (Cu) | 稀硫酸溶液、过滤 |
| D | CaCO3 | (Na2CO3) | 溶解、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |