题目内容
2.如图是实验室制取气体的一些装置,据图回答有关问题: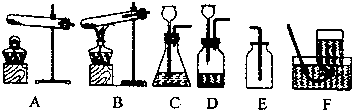
(1)加热固体物质制取气体,可选用的发生装置是A;
(2)写出实验室制(用高锰酸钾制)氧气的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;实验室制取氧气收集用的收集装置是E或F.
(3)适用E和F收集气体,分别利用的性质是密度比空气大,难溶于水或不易溶于水;
(4)写出实验室利用C制氧气的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;小林准备用装置B加热KMnO4来制取O2,你认为这样做可能产生的后果是试管炸裂
(5)实验室制二氧化碳用C 装置,化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
分析 根据制取气体的反应原理中所使用药品状态和反应条件,选择制取气体的发生装置;根据气体的收集装置选择决定于气体的性质,判断气体的性质;对用于对固体加热制取气体的装置B中存在问题进行分析.
解答 解:(1)加热固体物质制取气体,可选用的发生装置是有加热装置的A,故填:A;
(2)高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;因为氧气密度比空气大;难溶于水或不易溶于水,故实验室制取氧气收集用的收集装置是 E或F;
(3)气体的密度比空气大,用向上排空气法收集;气体难溶于水或不易溶于水,可用排水法收集,故适用E和F收集气体,分别利用的性质是:密度比空气大;难溶于水或不易溶于水;
(4)写出实验室利用C制氧气,不需要加热,故其化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;小林准备用装置B加热KMnO4来制取O2,试管口没向下倾斜,会使冷凝水倒流至试管底,引起试管炸裂;
(5)实验室制二氧化碳不需要加热,故选用装置为C,其化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:
(1)A;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑; E,F.
(3)密度比空气大,难溶于水或不易溶于水;
(4)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; 试管炸裂
(5)C,CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题主要考查常见气体的制取装置的选取和化学反应式的书写,需要同学们熟悉常见气体的制取装置和化学方程式的书写.

①2H ②2NH3 ③SO2 ④CuO ⑤Mg2+ ⑥2OH- ⑦H2O.
| A. | 表示离子个数的是⑤⑥ | B. | 表示离子所带电荷数的是④⑤ | ||
| C. | 表示分子中原子个数的是③⑦ | D. | 表示分子个数的是①② |
(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如下表.
| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |

(1)该实验中测得水的质量为1.8g,二氧化碳的质量为4.4g.
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1.
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中水蒸气和二氧化碳也分别被吸收到装置Ⅱ和装置Ⅲ中.
| A. | 催化剂专指二氧化锰 | |
| B. | 加入催化剂可以是氯酸钾产生更多的氧气 | |
| C. | 催化剂在反应前后所有的性质不变 | |
| D. | 同一个反应可以选用不同催化剂 |
| A. | C+O2═CO2 | B. | CaO+H2O═Ca(OH)2 | ||
| C. | CaCO3═CaO+CO2↑ | D. | 2H2O2═2H2O+O2↑ | ||
| E. | HCl+NaOH=NaCl+H2O |
| A. | 集气瓶、试管、量筒、铁架台 | B. | 酒精灯、试管、蒸发皿、铁架台 | ||
| C. | 酒精灯、试管、漏斗、烧杯 | D. | 集气瓶、试管、导管、铁架台 |
 通过对化学的学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究的方法.
通过对化学的学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究的方法.实验一、探究分子在不断运动(如图)
实验现象:B烧杯中的无色酚酞溶液变红.
该实验的探究方法是:对看不见、摸不着的粒子,要“观察”它的运动可设计实验,通过宏观的现象来间接认识.
实验二、探究二氧化碳与水的反应(取四朵用紫色石蕊溶液染成紫色的干燥的小花,进行如图所示实验)

实验现象:(Ⅰ)、(Ⅳ)中的小花变红.
设计(Ⅱ)、(Ⅲ)实验的目的是:验证水和二氧化碳分别是否能使紫色石蕊变色.
该实验的探究方法是:设计分析B(填“A”或“B”或“C”),获得结论.
A.仅一个单因素的实验
B.有多种因素的对比实验
C.用前面实验的生成物继续实验
实验三、验证二氧化碳与氢氧化钠溶液确实发生了反应(完成下列表格)(提示:含有碳酸根的物质遇到稀盐酸会放出二氧化碳气体,氢氧化钠溶液与氢氧化钙溶液的性质相似)
| 方案 | 实验步骤 | 实验现象 |
| 1 | 取两个等体积的软塑料瓶,充满二氧化碳,然后分别加入蒸馏水和氢氧化钠溶液,盖紧瓶塞,再加入等体积的蒸馏水和氢氧化钠溶液,盖紧瓶塞,震荡. | 加入氢氧化钠溶液的软塑料瓶比加入蒸馏水的软塑料瓶变得更瘪 |
| 2 | 先将二氧化碳通入盛有足量氢氧化钠溶液的试管 中,然后加入足量的盐酸. | 冒气泡 |
我认为方案1的探究方法是通过密闭容器内气体压强变化程度的对比来判断反应的发生,
方案2的探究方法是通过验证生成物的存在来判断反应的发生.
小结:上述三个实验告诉我们:当某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应.


