题目内容
1.为了测定某铜锌混合物中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
②试计算该铜锌合金中锌的质量分数(写出计算过程).52%
③从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
分析 (1)根据每一次反应生成的氢气质量和氢气的摩尔质量进行计算;
(2)根据锌和稀硫酸反应生成氢气,依据题中的氢气进行计算;
(3)根据表格提供的数据分析所以金属和硫酸的质量,然后依据反应的化学方程式计算即可.
解答 解:(1)每一次反应中生成氢气的物质的量是:$\frac{0.4g}{2g/mol}$=0.2mol;
(2)设Zn的物质的质量为x
Zn+H2SO4→ZnSO4+H2↑
1 1
x 0.2mol
$\frac{1}{x}$=$\frac{1}{0.2mol}$
x=0.2mol
所以Zn%=$\frac{0.2mol×65g/mol}{25g}$=52%;
(3)根据表格提供的数据可以看出,生成0.4g氢气,需要合金的质量是25g,需要硫酸的质量是100g,即合金与所用稀硫酸的质量之比为25g:100g=1:4时,二者恰好完全反应.
故答案为:(1)0.2mol;
(2)52%;
(3)1:4.
点评 根据表格提供的数据进行化学方程式的计算时,一定要善于从表格提供的数据找准反应物和生成的质量关系,然后进行正确的计算.

练习册系列答案
相关题目
11.以下实验操作正确的是( )
| A. | 用向下排空气法收集氧气 | B. | 用量筒量取一定量的液体药品 | ||
| C. | 将用剩的药品放回原试剂瓶 | D. | 用燃着的酒精灯点燃另一只酒精灯 |
16.密闭容器中,将3molCO和2molO2混合,一定条件下充分反应.下列说法正确的是( )
| A. | 反应后所得的气体是纯净物 | |
| B. | 反应后气体与原混合气体的物质的量之比为3:4 | |
| C. | 参加反应的CO和O2的物质的量之比为3:2 | |
| D. | 反应后的气体中C、O原子的物质的量之比为3:7 |
6.肉桂酸的分子式为C9H8O2,关于肉桂酸的说法正确的是( )
| A. | 有3种元素组成 | B. | 摩尔质量为148 | ||
| C. | 氧元素的质量分数最少 | D. | 1mol分子中含有19个原子 |
3. 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )| 序号 | 甲 | 乙 |
| A | HCl溶液 | Zn粒 |
| B | 石灰水 | 二氧化碳 |
| C | H2SO4溶液 | NaOH溶液 |
| D | AgNO3溶液 | Cu粉 |
| A. | A | B. | B | C. | C | D. | D |
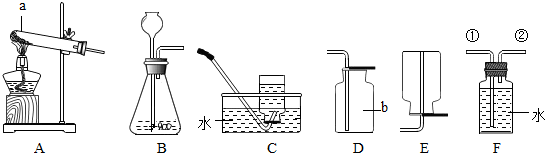
 化学课上我们曾经观察过如图所示的实验.
化学课上我们曾经观察过如图所示的实验.