题目内容
13.海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如图: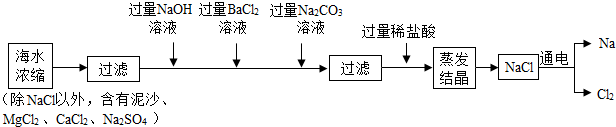
(1)过滤是将难溶性固体与液体分离的一中实验操作.在上述蒸发结晶的过程中发生了物理变化.
(2)加入过量Na2CO3溶液目的是除去CaCl2和氯化钡,流程中不能用过量稀硫酸代替过量稀盐酸的原因是引入了杂质硫酸钠和硫酸,请写出Na2CO3与CaCl2反应的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)我国古代湿法炼铜是将铁放入硫酸铜溶液中,请用化学方程式表示Fe+CuSO4═FeSO4+Cu.
依据炼铜与炼钠的反应条件不同,判断金属钠比铜获得更晚(填“更早”或“更晚”).
分析 (1)根据过滤、蒸发结晶的原理分析;
(2)根据碳酸钠能与氯化钡、氯化钙反应分析加入Na2CO3溶液目的,写出有关的方程式;硫酸能与碳酸钠反应生成了硫酸钠引入了杂质.
(3)根据铁与硫酸铜的反应和冶炼金属的条件分析回答有关的问题.
解答 解:(1)过滤是将难溶性固体与液体分离的一中实验操作.在上述蒸发结晶的过程中没有新物质生成,发生了物理 变化.
(2)由于碳酸钠能与氯化钡、氯化钙反应,所以加入过量Na2CO3溶液目的是除去CaCl2和氯化钡;由于硫酸能与碳酸钠反应生成了硫酸钠,硫酸不易挥发,所以在流程中不能用过量稀硫酸代替过量稀盐酸的原因是:引入了杂质硫酸钠和硫酸,Na2CO3与CaCl2反应的化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)我国古代湿法炼铜是将铁放入硫酸铜溶液中,由于铁的金属活动性比铜强,与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.依据炼铜与炼钠的反应条件不同可知,金属钠的制取需要通电熔融,比铜获得更晚.
故答为:(1)液体,物理.
(2)氯化钡,硫酸钠和硫酸,Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)Fe+CuSO4═FeSO4+Cu,更晚.
点评 本题主要考查了化学实验的基本操作和物质的分离提纯,熟悉酸碱盐的知识是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质中,只含有游离态氧元素的是( )
| A. | 蒸馏水 | B. | 氢氧化钠 | C. | 空气 | D. | 氧气 |
4.实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
1.为了测定某铜锌混合物中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
①每一次反应中生成氢气的物质的量是0.2mol.
②试计算该铜锌合金中锌的质量分数(写出计算过程).52%
③从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
②试计算该铜锌合金中锌的质量分数(写出计算过程).52%
③从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
8. 如图是用排空气法收集气体的装置,可用来收集H2、O2、CO2中的( )
如图是用排空气法收集气体的装置,可用来收集H2、O2、CO2中的( )
 如图是用排空气法收集气体的装置,可用来收集H2、O2、CO2中的( )
如图是用排空气法收集气体的装置,可用来收集H2、O2、CO2中的( )| A. | H2 | B. | H2和CO2 | C. | O2和CO2 | D. | H2、CO2、O2均可 |
18. 铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )
铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )
 铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )
铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )| A. | 是非金属元素 | B. | 原子序数为24 | ||
| C. | 相对原子质量为52.00g | D. | 中子数为24 |
5.在实验室中,小明同学为了探究金属与盐溶液的反应规律,将一定质量的某种金属M的粉末放入AgNO3与Cu(NO3)2的混合溶液中,实验过程及现象如图所示,结合实际现象判断,小明同学得出的以下结论中,错误的是( )


| A. | 溶液中一定没有银离子 | B. | 滤渣中一定含有金属单质M | ||
| C. | 滤渣中可能含有单质铜 | D. | 加入的金属M可能是单质锌 |
15.某黄铜制品的主要成分是铜和锌,课外小组将200g 稀硫酸不断地加到50g黄铜制品中得到如下数据
请回答以下问题:
(1)该50g黄铜制品中含有30.5g铜.
(2)求所用稀硫酸的溶质质量分数为多少?
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的质量/g | 50g | 50g | 50g | 50g |
| 剩余固体的质量/g | 43.5g | 37.0g | 30.5g | 30.5g |
(1)该50g黄铜制品中含有30.5g铜.
(2)求所用稀硫酸的溶质质量分数为多少?
 如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.