题目内容
15.元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:认真分析信息,回答:

(1)地壳中含量最多的金属元素的原子序数是13;
(2)9号、17号二种元素排在同一竖排的原因是最外层电子数相同;
(3)
 表示的是Ca2+(写粒子符号).
表示的是Ca2+(写粒子符号).(4)写出一个由1、7、8、16号四种元素组成的化合物的化学式(NH4)2SO4.
分析 (1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁进行分析解答本题;
(2)根据元素周期表的规律来分析;
(3)图 ,质子数=20,核外电子数=18,质子数>核外电子数,为带2个单位正电荷的钙离子;
,质子数=20,核外电子数=18,质子数>核外电子数,为带2个单位正电荷的钙离子;
(4)先推测1、7、8、16号四种元素的元素符号,再推测其组成的化合物的化学式.
解答 解:(1)地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,因此地壳中含量最多的金属元素是Al,由元素周期表可知,铝的原子序数为13;故填:13;
(2)9号、17号二种元素排在同一竖排的原因是其最外层电子数相同,故填:最外层电子数相同;
(3)图 ,质子数=20,核外电子数=18,质子数>核外电子数,为带2个单位正电荷的钙离子,其离子符号为:Ca2+.故填:Ca2+;
,质子数=20,核外电子数=18,质子数>核外电子数,为带2个单位正电荷的钙离子,其离子符号为:Ca2+.故填:Ca2+;
(4)由元素周期表可知,1、7、8、16号四种元素的元素符号分别为H、N、O、S;则可推测该化合物为铵根和硫酸根组成,利用化合价数值交叉法书写化学式,故其化学式为(NH4)2SO4.故填:(NH4)2SO4.
点评 了解元素周期表的特点及其应用;了解原子结构示意图与离子结构示意图的区别和联系;了解地壳中元素的分布与含量特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.用“分子的观点”解释下列现象,错误的是( )
| A. | 轮胎充气--分子间有间隔 | B. | 湿衣晾干--分子不停地运动 | ||
| C. | 水结成冰--分子本身发生变化 | D. | 气体受热膨胀--分子间间隔变大 |
3.甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应.甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳.
某化学小组为验证甲烷的组成,设计了如图所示实验.该实验装置气密性良好,实验中所用试剂均足量.
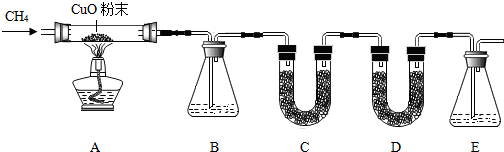
已知装置B、C、D、E中分别盛有浓硫酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色.
(1)实验步骤:
I.通入甲烷气体.
II.点燃酒精灯加热,反应一段时间后,停止加热.
III.继续通甲烷至玻璃管冷却.
(2)有关现象:
①A中黑色固体变红色;②中C中未见变蓝色;③E中未见出现浑浊.
(3)有关数据:
请回答下列问题:
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与C相同.
A.用石灰石与稀盐酸制二氧化碳B.用过氧化氢制氧气C.用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+2H2O+CO2.
(3)实验过程中通入甲烷的作用各不相同.步骤I是排尽除去装置中的空气;步骤II是还原氧化铜;步骤III是将生成的气体全部排出,减小实验误差.
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素.相关计算式为108.0g-106.4g=(212.9g-212.0g)×$\frac{16}{18}$×100%+(131.1g-131.0g)×$\frac{32}{44}$×100%=1.6g.
某化学小组为验证甲烷的组成,设计了如图所示实验.该实验装置气密性良好,实验中所用试剂均足量.

已知装置B、C、D、E中分别盛有浓硫酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色.
(1)实验步骤:
I.通入甲烷气体.
II.点燃酒精灯加热,反应一段时间后,停止加热.
III.继续通甲烷至玻璃管冷却.
(2)有关现象:
①A中黑色固体变红色;②中C中未见变蓝色;③E中未见出现浑浊.
(3)有关数据:
| A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
| 反应前 | 108.0 | 212.0 | 131.0 |
| 反应后 | 106.4 | 212.9 | 132.1 |
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与C相同.
A.用石灰石与稀盐酸制二氧化碳B.用过氧化氢制氧气C.用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+2H2O+CO2.
(3)实验过程中通入甲烷的作用各不相同.步骤I是排尽除去装置中的空气;步骤II是还原氧化铜;步骤III是将生成的气体全部排出,减小实验误差.
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素.相关计算式为108.0g-106.4g=(212.9g-212.0g)×$\frac{16}{18}$×100%+(131.1g-131.0g)×$\frac{32}{44}$×100%=1.6g.
20.为了测定某石灰石的纯度,小明同学把11克石灰石样品碾碎后投入到盛有94.4克稀盐酸的烧杯中(盐酸足量),充分反应后过滤,得到溶液100克.计算:
①石灰石的纯度.
②反应后所得溶液中溶质的质量分数.
①石灰石的纯度.
②反应后所得溶液中溶质的质量分数.
7.铝箔常用在食品包装上,因为铝具有良好的( )
| A. | 延展性 | B. | 导电性 | C. | 抗腐蚀性 | D. | 导热性 |
4.下列说法正确的是( )
| A. | 将23gNa投入到100g36.5%的盐酸中,所得溶液的溶质质量分数约为48% | |
| B. | 食品包装袋内的防腐剂、干燥剂和抗氧化剂等都是有害、有毒物质 | |
| C. | 电解水产物H2和O2的质量比为1:8,得出水分子中H、O元素个数比为2:1 | |
| D. | 葡萄糖分子式为C6H12O6,可以改写成C6(H12O6),所以葡萄糖由C和H2O组成 |
5.在探究某种古代金属钱币时,有同学认为他能和铁一样有磁性,提出“先拿磁铁来吸一下”.就“拿磁铁来吸一下”这一过程而言,属于科学探究中的( )
| A. | 假设 | B. | 实验 | C. | 观察 | D. | 做出结论 |
 你玩过拼图吗?以下拼图分别代表Fe、CO2、
你玩过拼图吗?以下拼图分别代表Fe、CO2、 钪是稀土金属,主要用于航天合金材料.
钪是稀土金属,主要用于航天合金材料.