题目内容
3.甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应.甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳.某化学小组为验证甲烷的组成,设计了如图所示实验.该实验装置气密性良好,实验中所用试剂均足量.
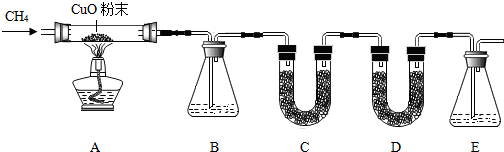
已知装置B、C、D、E中分别盛有浓硫酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色.
(1)实验步骤:
I.通入甲烷气体.
II.点燃酒精灯加热,反应一段时间后,停止加热.
III.继续通甲烷至玻璃管冷却.
(2)有关现象:
①A中黑色固体变红色;②中C中未见变蓝色;③E中未见出现浑浊.
(3)有关数据:
| A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
| 反应前 | 108.0 | 212.0 | 131.0 |
| 反应后 | 106.4 | 212.9 | 132.1 |
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与C相同.
A.用石灰石与稀盐酸制二氧化碳B.用过氧化氢制氧气C.用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+2H2O+CO2.
(3)实验过程中通入甲烷的作用各不相同.步骤I是排尽除去装置中的空气;步骤II是还原氧化铜;步骤III是将生成的气体全部排出,减小实验误差.
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素.相关计算式为108.0g-106.4g=(212.9g-212.0g)×$\frac{16}{18}$×100%+(131.1g-131.0g)×$\frac{32}{44}$×100%=1.6g.
分析 (1)根据反应物的状态和反应条件确定发生装置;
(2)根据甲烷还原氧化铜的反应,写出反应的化学方程式;
(3)步骤Ⅰ、根据甲烷是可燃性的气体与空气的混合气体在点燃时易发生爆炸分析回答;
步骤Ⅱ、根据装置中有残留的二氧化碳水蒸气等分析;
(4)根据生成的二氧化碳中氧元素的质量和生成的水中氧元素的质量等于氧化铜中氧元素的质量分析.
解答 解:(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,属于加热固体制取气体,发生装置类型与用高锰酸钾制氧气相同.
(2)由题意可知,甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳,反应的化学方程式是:CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+2H2O+CO2.
(3)实验过程中通入甲烷的作用各不相同.由于甲烷是可燃性的气体与空气的混合气体在点燃时易发生爆炸,所以步骤Ⅰ通入甲烷的作用是排尽除去装置中的空气; 由于反应完后的装置中有残留的二氧化碳、水蒸气,所以步骤Ⅱ中通入甲烷的作用是将生成的气体全部排出,减小实验误差.
(4)由A中玻璃管及物质总质量可知,减少的质量就是氧元素的质量为:108.0g-106.4g=1.6g,
生成的二氧化碳和水中氧元素的质量为:(212.9g-212.0g)×$\frac{16}{18}$×100%+(131.1g-131.0g)×$\frac{32}{44}$×100%=1.6g,所以甲烷中不含有氧元素.
故答为:(1)C;(2)CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+2H2O+CO2;(3)排尽除去装置中的空气;将生成的气体全部排出,减小实验误差;(4)108.0g-106.4g=(212.9g-212.0g)×$\frac{16}{18}$×100%+(131.1g-131.0g)×$\frac{32}{44}$×100%=1.6g.
点评 本题以实验探究的形式考查常见甲烷、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案| 主食 | 米饭、馒头 |
| 副食 | 烧鱼块、咸鸭蛋、红烧肉、花生米 |
| 饮料 | 牛奶 |
| 我的补充 | ---- |
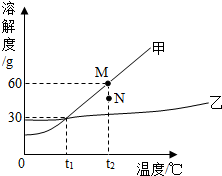 如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )| A. | 甲的溶解度受温度变化影响比乙大 | |
| B. | t1℃时,甲、乙两物质饱和溶液中溶质的质量分数相同 | |
| C. | 要使组成在N点的甲溶液转变为M点的甲溶液,可以采用升高温度的方法 | |
| D. | 乙采用蒸发溶剂的方法得到乙晶体 |


 表示的是Ca2+(写粒子符号).
表示的是Ca2+(写粒子符号).
