题目内容
20.为了测定某石灰石的纯度,小明同学把11克石灰石样品碾碎后投入到盛有94.4克稀盐酸的烧杯中(盐酸足量),充分反应后过滤,得到溶液100克.计算:①石灰石的纯度.
②反应后所得溶液中溶质的质量分数.
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据提供的数据和反应的化学方程式可以进行相关方面的计算.
解答 解:①设碳酸钙质量为x,生成氯化钙质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,溶液质量增加
100 111 44 100-44=56
x y 100g-94.4g=5.6g
$\frac{100}{x}$=$\frac{111}{y}$=$\frac{56}{5.6g}$,
x=10g,y=11.1g,
石灰石的纯度为:$\frac{10g}{11g}$×100%=90.9%,
答:石灰石的纯度为90.9%.
②反应后所得溶液中溶质的质量分数为:$\frac{11.1g}{100g}$×100%=11.1%,
答:反应后所得溶液中溶质的质量分数为11.1%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
10.将10%的氨水与20%的氨水等体积混合时溶质质量分数( )
| A. | 15% | B. | >15% | C. | <15% | D. | 上述情况均可能 |
8.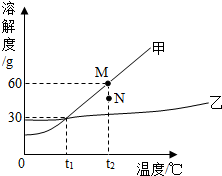 如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
 如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )| A. | 甲的溶解度受温度变化影响比乙大 | |
| B. | t1℃时,甲、乙两物质饱和溶液中溶质的质量分数相同 | |
| C. | 要使组成在N点的甲溶液转变为M点的甲溶液,可以采用升高温度的方法 | |
| D. | 乙采用蒸发溶剂的方法得到乙晶体 |
5.下列化学方程式不正确的是( )
| A. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Fe+CuSO4=FeSO4+Cu | D. | CH4+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O |
9.从水分子分解示意图中我们能获得许多信息,其中描述错误的是( )

| A. | 该反应过程中元素的种类不变 | B. | 该反应过程中分子的种类不变 | ||
| C. | 在化学变化中原子是最小的粒子 | D. | 氢分子能保持氢气的化学性质 |

 表示的是Ca2+(写粒子符号).
表示的是Ca2+(写粒子符号).
 某研究小组的同学在实验室模拟地震后,灾区居民饮用水处理的过程初步方案如下,请回答下列问题:
某研究小组的同学在实验室模拟地震后,灾区居民饮用水处理的过程初步方案如下,请回答下列问题: