题目内容
7.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题
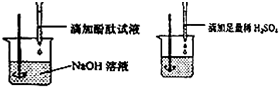
①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
分析 氢氧化钠溶液呈碱性,其PH大于7,能使酚酞试液变红,硫酸呈酸性,其PH小于7,不能使酚酞试液变色,氢氧化钠和硫酸反应能生成硫酸钠和水,该反应为放热反应.
解答 解:(1)氢氧化钠溶液呈碱性,其PH大于7,硫酸呈酸性,其PH小于7;故填:<;硫酸;
(2)①由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠和硫酸反应生成硫酸钠和水,溶液呈中性或酸性,均不能使酚酞变色;故填:红;无;
②反应后滴加酚酞试液,无法对反应是否进行进行判断,因为酸性溶液和中性溶液都不能使得酚酞试液变红色,故填:小文;如果硫酸过量,加入酚酞试液,溶液也不变色;
酸性溶液能使紫色的石蕊试液变红色,故可用石蕊试液来检验溶液是否呈酸性.
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL, 滴加几滴紫色石蕊试液等,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
点评 本题考查了酸碱中和反应,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
17.X、Y、Z分别是硫酸、氢氧化钙、食盐三种溶液,将无色酚酞试液滴入X溶液变为红色,将此红色溶液少量滴入Y中仍为红色,则X、Y、Z依次是( )
| A. | 硫酸、氢氧化钙、食盐 | B. | 硫酸、食盐、氢氧化钙 | ||
| C. | 氢氧化钙、硫酸、食盐 | D. | 氢氧化钙、食盐、硫酸 |
18.4.6g某有机物完全燃烧时需要消耗9.6g氧气,生成8.8g二氧化碳和5.4g水,该有机物中( )
| A. | 只含碳、氢两种元素 | B. | 只含碳元素 | ||
| C. | 含碳、氢、氧元素 | D. | 可能含氧元素 |
2.下列物质露置在空气中质量增加且有新物质生成的是( )
| A. | 生石灰 | B. | 浓盐酸 | C. | 浓硫酸 | D. | 浓氨水 |
12.下列实验操作中正确的是( )
| A. | 多取的药品放入指定容器内 | B. | 在量筒里稀释浓硫酸 | ||
| C. | 用取过酸的滴管直接取酚酞试液 | D. | 过滤时用玻璃棒在漏斗内搅拌 |
19.将下列物质投入水中时,吸收热量的是( )
| A. | 生石灰 | B. | NH4NO3固体 | C. | 浓硫酸 | D. | 苛性钠 |
16.填写空格中的名称或化学式
| 化学式 | NO2 | ||||
| 名 称 | 氧化铁 | 硫酸钠 | 氯化镁 | 氦气 |
17.下列各组物质的溶液不用其它试剂就可鉴别的是( )
| A. | HCl CuSO4 KNO3 Na2SO4 | B. | FeCl3 HCl NaCl NaOH | ||
| C. | CaCl2 K2CO3 HCl (NH4)2CO3 | D. | NaNO3 Na2SO4 HCl H2SO4 |