题目内容
15.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.(1)按人类开始使用这三种金属的先后排序为Cu、Fe、Al(用元素符号表示);
(2)分别列举这三种金属的一种用途:铝做超高电压的电缆,铁炊具,铜导线;
(3)小明认为用稀盐酸可以区别开这三种金属,写出其中发生的两个化学方程式
2Al+6HCl=2AlCl3+3H2↑,Fe+2HCl=FeCl2+H2↑;;
(4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度大(填“大”或“小”).
分析 (1)人类使用金属的顺序正好和金属的活动性相反,金属活动性越强的金属越难冶炼;
(2)根据金属的用途分析;
(3)氢前的金属可与酸反应生成氢气,且金属的活动性越强,与酸反应时越剧烈;
(4)根据合金的性质进行分析.
解答 解:(1)活动性弱的金属不易发生化学反应,能以单质形式存在,并比较容易冶炼,故人类使用金属的顺序正好和金属的活动性相反;
(2)纯铝可做超高电压的电缆;铁可做炊具;铜可做导线;
(3)氢前的金属可与酸反应生成氢气,且金属的活动性越强,与酸反应时越剧烈,因此可以根据金属与酸反应的情况判断铝、铁、铜是的活动性,铝、铁与酸反应,且铝反应比铁剧烈,铜不反应,化学方程式为:2Al+6HCl=2AlCl3+3H2↑;Fe+2HCl=FeCl2+H2↑;
(4)合金的硬度比纯金属要大,钢就比纯铁硬度大的多.
故答案为:(1)Cu、Fe、Al;
(2)做超高电压的电缆;炊具;导线;
(3)2Al+6HCl=2AlCl3+3H2↑;Fe+2HCl=FeCl2+H2↑;
(4)大.
点评 题主要考查了常见金属的有关性质知识,完成此题,要熟记和理解金属的性质及用途、常见金属的特性及其应用等相关知识,进行选择或解答即可.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
6.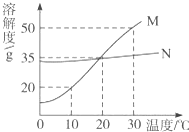 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:
M、N两种固体物质的溶解度曲线如图所示,试完成下列问题:
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:| 20℃时溶解度/g | >10 | 10-1 | 1-0.01 | <0.01 |
| 溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
10.下列有金属材料的叙述正确的是( )
| A. | “真金不怕火炼”是指金的熔点很高,受热不会熔化 | |
| B. | 铁器表面的铁锈具有致密的结构,因此它能保护内部的铁不再锈蚀 | |
| C. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 | |
| D. | 被腐蚀的铁制品不应该回收 |
20.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,充分反应,实验数据如下:
(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)
(2)反应过程中产生氢气的质量是多少?
(3)最后烧杯中所盛物质的总质量是多少?
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
(2)反应过程中产生氢气的质量是多少?
(3)最后烧杯中所盛物质的总质量是多少?
7.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题
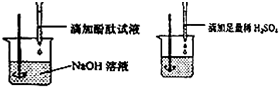
①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题

①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
5.下列说法中正确的是( )
| A. | 木炭燃烧后生成黑色固体 | B. | 镁条在空气中燃烧发出耀眼的白光 | ||
| C. | 红磷在空气中不能燃烧 | D. | 硫燃烧时生成无色无味的气体 |
 :
: