题目内容
16.填写空格中的名称或化学式| 化学式 | NO2 | ||||
| 名 称 | 氧化铁 | 硫酸钠 | 氯化镁 | 氦气 |
分析 根据物质的名称可以书写物质的化学式,根据物质的化学式可以判断物质的名称.根据化合物(先读后写,后读先写;金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)化学式的书写方法、读法进行书写即可.
解答 解:氧化铁中,铁元素显+3价,氧元素显-2价,故氧化铁的化学式为Fe2O3;根据氧化物的命名方法可知,NO2读作二氧化氮;硫酸钠中,钠元素显+1价,硫酸根显-2价,故硫酸钠的化学式为Na2SO4;氯化镁中,镁元素显+2价,氯元素显-1价,故氯化镁的化学式为MgCl2;氦气的化学式是He.故填:He.
故答案为:
| 化学式 | Fe2O3 | NO2 | Na2SO4 | MgCl2 | He |
| 名 称 | 氧化铁 | 二氧化氮 | 硫酸钠 | 氯化镁 | 氦气 |
点评 本题难度不大,掌握单质、化合物化学式的书写方法、读法是正确解答本题的关键.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
6. 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:
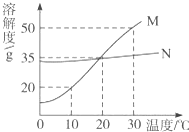
M、N两种固体物质的溶解度曲线如图所示,试完成下列问题:
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:| 20℃时溶解度/g | >10 | 10-1 | 1-0.01 | <0.01 |
| 溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
7.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题
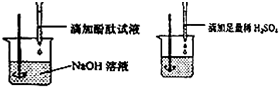
①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题

①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
5.下列说法中正确的是( )
| A. | 木炭燃烧后生成黑色固体 | B. | 镁条在空气中燃烧发出耀眼的白光 | ||
| C. | 红磷在空气中不能燃烧 | D. | 硫燃烧时生成无色无味的气体 |