题目内容
18.4.6g某有机物完全燃烧时需要消耗9.6g氧气,生成8.8g二氧化碳和5.4g水,该有机物中( )| A. | 只含碳、氢两种元素 | B. | 只含碳元素 | ||
| C. | 含碳、氢、氧元素 | D. | 可能含氧元素 |
分析 有机物+O2$\stackrel{点燃}{→}$CO2+H2O.反应物的质量总和为4.6g+9.6g=14.2g,生成物的质量总和为8.8g+5.4g=14.2g,根据质量守恒定律可知4.6g此有机物和9.6g氧气全部参加了反应.从定性的角度可推断该有机物中一定含有碳、氢两种元素,可能含有氧元素.要确定此有机物中是否含有氧元素,则要根据质量守恒定律中反应前后元素的质量守恒这一原则,计算出8.8gCO2和5.4gH2O中碳元素、氢元素的质量总和是否等于该有机物的质量,如果8.8gCO2和5.4gH2O中碳元素、氢元素的质量总和小于有机物的质量4.6g,则此有机物中含有氧元素.
解答 解:由质量守恒定律可推断该有机物中一定含有碳、氢两种元素,可能含有氧元素.8.8gCO2中碳元素的质量为8.8g×$\frac{12}{44}$=2.4g,5.4gH2O中氢元素的质量为5.4g×$\frac{2}{18}$=0.6g,
故该有机物中碳元素和氢元素的质量为2.4g+0.6g=3g,小于有机物的质量4.6g,所以该有机物中含有氧元素.
故选C.
点评 本题解题的关键是根据质量守恒定律,反应前后元素种类、质量均相等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
6.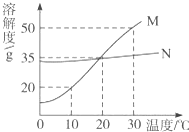 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:
M、N两种固体物质的溶解度曲线如图所示,试完成下列问题:
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:| 20℃时溶解度/g | >10 | 10-1 | 1-0.01 | <0.01 |
| 溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
(1)M物质的溶解性属于易溶.
(2)在20℃时,M、N两种物质的溶解度相等.
(3)在30℃时,将20g M物质(不含结晶水)完全溶于100g水中,得到不饱和溶液,若要将其转化成饱和溶液,下列措施可采取的是AB.
A.再加入30g M物质 B.将温度降低到10℃C.倒掉溶液30g.
10.下列有金属材料的叙述正确的是( )
| A. | “真金不怕火炼”是指金的熔点很高,受热不会熔化 | |
| B. | 铁器表面的铁锈具有致密的结构,因此它能保护内部的铁不再锈蚀 | |
| C. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 | |
| D. | 被腐蚀的铁制品不应该回收 |
7.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题
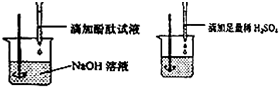
①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题

①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.




 为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4 :
: