题目内容
2.下列物质露置在空气中质量增加且有新物质生成的是( )| A. | 生石灰 | B. | 浓盐酸 | C. | 浓硫酸 | D. | 浓氨水 |
分析 物质露置在空气中质量增加且有新物质生成则物质与其他物质发生了化学反应,据此分析.
解答 解:A、生石灰露置在空气中与水发生反应生成氢氧化钙而使质量增加,故A正确;
B、浓盐酸具有挥发性,挥发出溶质而使质量减小,故B错误;
C、浓硫酸具有吸水性,露置质量会增加,但是不发生化学变化,故C错误;
D、浓氨水具有挥发性,挥发出溶质而使质量减小,故D错误.
故选A.
点评 本题考查了常见物质的放置导致的质量变化,完成此题,可以依据物质的性质进行.

练习册系列答案
相关题目
12.甲同学在探究酸的性质时,误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生.他联想到MnO2可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白.
【猜想】Fe2O3能作为H2O2分解的催化剂.
【实验验证】甲同学依次设计了三个实验:
实验一取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃.说明H2O2溶液常温下缓慢分解.
实验二在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃.说明Fe2O3能加快H2O2的分解速率
实验三待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g.说明反应前后Fe2O3的质量保持不变
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂.
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再
补充一个探究实验.这一探究实验的目的是:反应前后Fe2O3的化学性质是否改变(或反应前后Fe2O3是否转化为其他物质)
【深入探究】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论?(答出两点)①相同条件下,MnO2的催化效果比Fe2O3好②其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快
(表中数据是用足量等体积H2O2溶液制取相同体积O2所需的时间)
【猜想】Fe2O3能作为H2O2分解的催化剂.
【实验验证】甲同学依次设计了三个实验:
实验一取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃.说明H2O2溶液常温下缓慢分解.
实验二在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃.说明Fe2O3能加快H2O2的分解速率
实验三待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g.说明反应前后Fe2O3的质量保持不变
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂.
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再
补充一个探究实验.这一探究实验的目的是:反应前后Fe2O3的化学性质是否改变(或反应前后Fe2O3是否转化为其他物质)
【深入探究】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论?(答出两点)①相同条件下,MnO2的催化效果比Fe2O3好②其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快
| 浓度时间催化剂 | 30%H2O2溶液 | 15% H2O2溶液 | 5% H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入WgFe2O3 | 7.0 | 9.0 | 16.0 |
10.下列有金属材料的叙述正确的是( )
| A. | “真金不怕火炼”是指金的熔点很高,受热不会熔化 | |
| B. | 铁器表面的铁锈具有致密的结构,因此它能保护内部的铁不再锈蚀 | |
| C. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 | |
| D. | 被腐蚀的铁制品不应该回收 |
7.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题
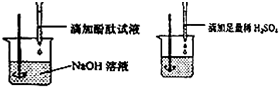
①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后NaOH溶液的pH,pH<7(选填“>”、“<”或“=”).
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且硫酸过量.
(2)方案二:探究反应终点问题

①小红说:根据图示实验步骤进行实验,观察到滴加的无色酚酞试液由红色刚好变成
无色.
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行.
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行.
分析】:你认为他们的说法,不正确的是小文,理由是如果硫酸过量,加入酚酞试液,溶液也不变色.
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三次.
14.如图是镁和氯两种元素的有关信息,则下列说法错误的是( )


| A. | 镁原子结构图中X=8 | |
| B. | 氯元素的原子序数为17 | |
| C. | 镁是金属元素、氯是非金属元素 | |
| D. | 镁原子和氯原子都易在化学反应中失去电子 |
12.没有水就没有生命下列关于水的说法中不正确的是( )
| A. | 水是化合物 | B. | 水由氢、氧两种元素组成 | ||
| C. | 水由水分子构成 | D. | 水由两个氢原子和一个氧原子构成 |
 为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4 如图A~H都是初中化学中常见的物质,已知A、B、C为化合物,D、E、F、G、H均为单质,且D是目前年产量最高的金属,F为紫红色固体单质,G、H均为气体.它们的转化关系如图所示(其中“-”表示相连的物质能反应,“→”表示存在转化关系).请回答:
如图A~H都是初中化学中常见的物质,已知A、B、C为化合物,D、E、F、G、H均为单质,且D是目前年产量最高的金属,F为紫红色固体单质,G、H均为气体.它们的转化关系如图所示(其中“-”表示相连的物质能反应,“→”表示存在转化关系).请回答: