1、 鲍林近似能级图与周期表的关系: 能级组 周期 元素个数

|
近似能级图:按原子轨道能量高低顺序排列的图。 能级组:能量相近的能级划为一组
能级组内各轨道能量相近,不同能级组之间能量差别较大。能级组的划分是造成元素周期表中元素划分为周期的本质原因。
 ①、按原子序数递增的顺序从左到右排列;
①、按原子序数递增的顺序从左到右排列;
 排列原则 ②、将电子层数相同的元素排成一个横行;
排列原则 ②、将电子层数相同的元素排成一个横行;
③、把最外层电子数相同的元素(个别除外)排成一个纵行。

 ①、短周期(一、二、三周期)
①、短周期(一、二、三周期)
2、基态原子的电子排布的三个原理
(1)能量最低原理:基态原子的核外电子排布遵循构造原理,电子总是优先排布在能量最低的原子轨道里,然后再依次进入能量逐渐升高的原子轨道,这样使整个原子处于最低的能量状态。
构造原理:
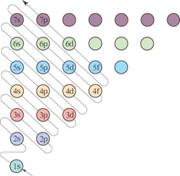
三层以上的电子层中出现能级交错现象,对核外电子排布的影响很大。
规律:①能量顺序按照1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4 5d 6p 7s……
能量由低到高
即按照ns (n-2)f (n-1)d np顺序排列
②能量高低1s<2s<3s …… 2p<3p<4p…… ns<np<nd<nf
实例:17Cl的电子排布是1s22s22p63s23p5;若写为1s12s22p63s23p6则违背了能量最低原理
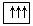
 (2)泡利不相容原理:每个原子轨道上最多只能容纳两个电子,且自旋方向相反。
(2)泡利不相容原理:每个原子轨道上最多只能容纳两个电子,且自旋方向相反。
实例:氮原子的轨道表示式是:1s 2s 2p

|

|

|

|
|
 (3)洪特规则:当电子排布在同一能级的不同轨道时,应尽可能分占不同的轨道并且自旋方向相同(或平行)。
1s 2s 2p
1s 2s 2p
(3)洪特规则:当电子排布在同一能级的不同轨道时,应尽可能分占不同的轨道并且自旋方向相同(或平行)。
1s 2s 2p
1s 2s 2p
|

|
|
|
洪特规则的特例:对于同一个能级当电子排布为全充满、半充满或全空时是比较稳定的。 全充满:p6,d10,f14
 相对稳定的状态
半充满:p3,d5,f7
相对稳定的状态
半充满:p3,d5,f7
全空:p0,d0,f0
实例:铬 24Cr [Ar]3d54s1 铜 29Cu [Ar]3d104s1
1、能层和能级
在多电子原子中,电子的排布分成不同的能层,同一能层的电子能量也可能不同,还可以分成不同的能级。
|
电子层(能层) |
原子轨道类型(能 级) |
原子轨道数目 |
最多容纳电子数 |
|
K(1) |
1s |
1 |
2 |
|
L(2) |
2s 2p |
4 |
8 |
|
M(3) |
3s 3p 3d |
9 |
18 |
|
N (4) |
4s 4p 4d 4f |
16 |
32 |
|
O(5) |
5s 5p 5d 5f 5g |
25 |
50 |
|
……(n) |
|
n 2 |
2n 2 |
(1) 任一能层,能级数=能层序数
(2) s、p、d、f……的轨道数依次是1、3、5、7……
(3) s、p、d、f……可容纳的电子数依次是其轨道数1、3、5、7……的两倍
(4) 各电子层最多容纳的电子数为2n2个。
(5) 最外层最多容纳8个电子;次外层最多容纳18个(若此外层为1或2,最多只能有2或8个电子);倒数第三层最多只有32个电子(若该层n=1,2,3,最多只能有2,8,18个电子)

 的首项为3,公差为2,则
的首项为3,公差为2,则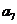 的值等于
的值等于
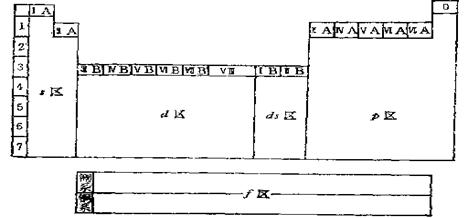 元素周期表分区
元素周期表分区
 的结构
周期(7个横行) ②、长周期(四、五、六周期)
的结构
周期(7个横行) ②、长周期(四、五、六周期) Cl-离子
Cl-离子 
 1s 2s 2p
1s 2s 2p


