2、元素、核素、同位素、同素异形体:
|
|
元素 |
同位素 |
核素 |
同素异形体 |
|
概念 |
具有相同核电荷数的同一类原子的总称 |
质子数相同而中子数不同的用一元素的不同原子互称为同位素(化学性质几乎完全相同,只是某些物理性质略有不同) |
具有一定数目的质子和一定数目的中子的一种原子 |
由同种元素组成的结构和性质不同的单质互称为同素异形体 |
|
例 |
氧(O)元素 氢(H)元素 |
如160、17O、180是氧元素的三种核素,互为同位素 。 。 |
如1H(H)、2H(D)、3H(T)就各为一种核素。 |
O2和O3 红磷和白磷 金刚石和石墨 |

|
|
 中子N(0)
核素、同位素
中子N(0)
核素、同位素

 原子核
原子核
|
|
|
 质子Z(+1)
元素符号
质子Z(+1)
元素符号
原子结构 最外层电子数:
 电子数:
电子数:
核外电子
|
 内层电子数:
内层电子数:



e(-1)
排布规律 :分层排布 周期序数及原子半径
1、原子中存在的两个关系式是:
① 质量关系:质量数A=Z+N
(1个质子质量约为1.673×10-27Kg,1个中子质量约为1.675×10-27Kg,用其分别与12C原子质量的1/12(1.661×10-27Kg)相比而得1个质子和中子相对质量分别为1.007和1.008,1个电子的相对质量约为质子质量的1/1836,所以,原子的质量主要集中在原子核上)
② 电子关系:中性原子的核外电子数=质子数=核电荷数= 原子序数
阳离子的核外电子数=质子数-阳离子所带电荷数
阴离子的核外电子数=质子数 + 阳离子所带电荷数
实例:微粒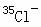 所含质子数__17___;中子数__35-17=18____;电子数_17+1=18___;质量数__35____。
所含质子数__17___;中子数__35-17=18____;电子数_17+1=18___;质量数__35____。
 实例:(1) Cl元素的两种核素35Cl、37Cl的相对原子质量分别34.969和36.966,则35Cl和37Cl的关系是___同位素___。其质量数分别是__35___、___37___。
实例:(1) Cl元素的两种核素35Cl、37Cl的相对原子质量分别34.969和36.966,则35Cl和37Cl的关系是___同位素___。其质量数分别是__35___、___37___。 脱氧核糖核酸(DNA)
脱氧核糖核酸(DNA)