摘要:元素周期表分区 几个量的关系: (1)原子序数=核电荷数=质子数 =核外电子数 (2)周期序数=核外电子层数=能级组数.每周期元素数目=该能级组容纳电子总数. (3)族的序数=特征电子数之和 a.主族序数=最外层电子数=元素的最高正价数(F无正价.O一般也无正价) b. ⅢB到ⅦB和Ⅷ族的第一列:最高能级组中的电子总数=族数 如:钪[Ar] 3d14s2 ⅠB和ⅡB:最外层电子数=族数 如: 铜 29Cu [Ar]3d104s1 铁[Ar]3d64s2 (4) 非金属元素|最高正价数|+|负价数|=8 实例:已知某元素在周期表中位于第五周期.ⅥA族位置上.试写出该元素的基态原子的电子排布式.元素的名称.符导和原子序数. 解:元素位于第五周期.故电子的最高能级组是第五能级组,元素是ⅥA族的.故最外层电子数应为6.故有5s25p4,ⅥA族属于p区.其4d一定是全充满的.电子结构式为[Kr]4d105s25p4.元素名称是碲.符导Te.核外共有52个电子.原子序数是52.
网址:http://m.1010jiajiao.com/timu_id_4462678[举报]
请回答下列问题:

(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是______.
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为______;O与F电负性大到小的顺序为______.(用<或=或>表示)
(3)34号元素的价层电子的电子排布图为______,在周期表位于______区;Mn2+基态的电子排布式为______.
(4)气态SO2分子的立体构型为______;SO32-离子的立体构型为______(均用文字描述)
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:______;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是______.
查看习题详情和答案>>

(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是______.
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为______;O与F电负性大到小的顺序为______.(用<或=或>表示)
(3)34号元素的价层电子的电子排布图为______,在周期表位于______区;Mn2+基态的电子排布式为______.
(4)气态SO2分子的立体构型为______;SO32-离子的立体构型为______(均用文字描述)
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:______;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是______.
查看习题详情和答案>>
请回答下列问题:
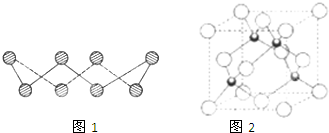
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
(3)34号元素的价层电子的电子排布图为
(4)气态SO2分子的立体构型为
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为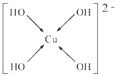
 .
.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
查看习题详情和答案>>

(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
.(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
Al>Mg
Al>Mg
;O与F电负性大到小的顺序为F>O
F>O
.(用<或=或>表示)(3)34号元素的价层电子的电子排布图为
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p4
,在周期表位于第四周期第ⅥA族
第四周期第ⅥA族
区;Mn2+基态的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(4)气态SO2分子的立体构型为
V形
V形
;SO32-离子的立体构型为三角锥型
三角锥型
(均用文字描述)(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
;(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为


(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
CuCl
CuCl
.