网址:http://m.1010jiajiao.com/timu_id_4462667[举报]
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1) △H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚;2CH3OH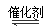 CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol
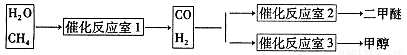
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:

(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数) 。
(2)①方法中用甲醇液体与浓硫酸作用直接脱水制二甲醚,尽管产率高,但是逐步被淘汰的主要原因是 。
(3)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
(4)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
(填序号)。
CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
(填序号)。

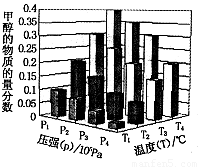
A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3 D.P1>P4 T2>T3
(5)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0写出平衡常数的表达式:
。如果温度降低,该反应的平衡常数
。(填“不变”、“变大”、“变小”)
CO(g)+3H2(g)
△H>0写出平衡常数的表达式:
。如果温度降低,该反应的平衡常数
。(填“不变”、“变大”、“变小”)
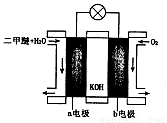
(6)如图为绿色电源“二甲醚燃料电池”的工作原理示意图。则a电极的反应式为:________________。

查看习题详情和答案>>
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料(已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol)。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚;
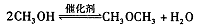
②合成气CO与H2直合成二甲醚:
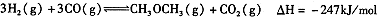
③天然气与水蒸气反应制备二甲醚。以CH4和H20为原料制备二甲醚和甲醇工业流程如下:
(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式 。
(2)①方法中用甲醇液体与浓硫酸作用直接脱水制二甲醚,尽管产率高,但是逐步被淘汰的主要原因是 。
(3)在反应室2中,一定条件下发生反应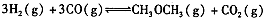 在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是____。
在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是____。
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
(4)在反应室3中,在一定温度和压强条件下发生了反应: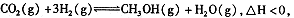 反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 .(填序号)。
反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 .(填序号)。
(5)反应室1中发生反应: 写出平衡常数的表达式: 。如果温度降低,该反应的平衡常数 。(填“不变”、
写出平衡常数的表达式: 。如果温度降低,该反应的平衡常数 。(填“不变”、
“变大”、“变小”)
(6)下图为绿色电源“二甲醚燃料电池”的工作原理示意图。则a电极的反应式为:_ ___。
查看习题详情和答案>>
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)? △H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚; 2CH3OH  CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚: 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)?? △H=-247kJ/mol
CH3OCH3(g)+CO2(g)?? △H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:

(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数)????????????????????????????????????????????????
(2)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是?????
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是?????
A.低温高压?? B.加催化剂??? C.增加CO浓度?? D.分离出二甲醚
(3)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g)? △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是??? (填序号)
CH3OH(g)+H2O (g)? △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是??? (填序号)

A.P3>P2?? T3>T2?????? B.P2>P4?? T4>T2
C.P1>P3 ? T1>T3?????? D.P1>P4?? T2>T3
(4)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)? △H>0写出平衡常数的表达式:??????????????????????????
CO(g)+3H2(g)? △H>0写出平衡常数的表达式:??????????????????????????
如果温度降低,该反应的平衡常数????????????? (填“不变”、“变大”、“变小”)

(5)如图为绿色电源“二甲醚燃料电池”的工作原理示意图则a电极的反应式为:________________

(6)下列判断中正确的是_______
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H+ + 4eˉ = 2H2O,溶液pH降低
查看习题详情和答案>>
化学科学的形成和发展
1.人类的化学实践活动起源于对________的使用.
2.化学科学是在________的基础上逐渐形成的.
3.化学科学的发展:
化学科学经历了3个过程:古代化学→近代化学→现代化学
 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:n-C4H9OH+NaBr+H2SO4→n-C4H9Br+NaHSO4+H2O
副反应:n-C4H9OH
| 浓H2SO4 |
| △ |
2n-C4H9OH
| ||
| △ |
3H2SO4(浓)+2NaBr(固)═2NaHSO4+Br2↑+SO2↑+2H2O
已知反应物及其用量:固体NaBr0.24mol,n-C4H9OH0.20mol,浓H2SO429mL,H2O20mL.
制备过程经历如下五个步骤,试回答下列问题:
1.投料:在圆底烧瓶中加入20mL水,再慢慢加入29mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20mol正丁醇(约18mL)和0.24mol溴化钠,充分振荡后加入几粒沸石.
(1)冷却至室温后再加正丁醇和溴化钠的目的是
A.减少HBr的挥发B.防止正丁醇的挥发
C.防止溴化钠被氧化D.防止温度过高导致炭化结焦
(2)本反应中硫酸与溴化作作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷.硫酸的用量和浓度过大都对本制备不利的主要原因是
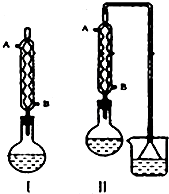
2.加热回流:反应装置选择Ⅱ而不选择Ⅰ的原因是
3.分离粗产物:反应结束待反应液冷却后,用直形冷凝管换下球形冷凝管,将其变为蒸馏装置进行蒸馏,得到的粗产物中除主产品外,还含下列选项中的
①C4H9OH ②SO2 ③(C4H9)2O ④Br2⑤NaHSO4 ⑥H2O ⑦H2SO4
4.洗涤粗产物:将馏出液移至分液漏斗中,加入等体积的水洗涤后,分液得有机层.如果不能判断哪层是有机层,可以用
5.收集产物:将干燥好的产物移至小蒸馏瓶中,加热蒸馏,收集99-103℃的馏分.要证明最终产物是n-C4H9Br,方法是