(二)知识框架
1.半导体材料与单质硅
①单质硅的物理性质:
②硅的化学性质:常温下不活泼,除氟气、氢氟酸和强碱外,一般不与其他物质反应。加热条件下,可与氧气反应。
Si + O2 加热===== SiO2 Si + 2F2 === SiF4 Si + 4HF === SiF4 ↑+ 2H2↑
③硅的工业制法:
工业上,用焦炭在电炉中还原SiO2得到含有少量杂质的粗硅后再提纯。
SiO2 + 2C 高温===== Si + 2CO↑
④硅的主要用途:作半导体材料;制造太阳能电池;制造硅合金等。
2.二氧化硅与光导纤维
①物理性质
②化学性质
SiO2 + 2NaOH == Na2SiO3 + H2O SiO2 + CaO 高温===== CaSiO3
SiO2 + 4HF == SiF4↑ + 2H2O
③二氧化硅的用途:制造电子元器件、光学仪器、精密仪器轴承、光导纤维、石英钟、工艺品、玻璃等。
3.硅酸盐与无机非金属材料
①玻璃、水泥
|
|
玻 璃 |
水 泥 |
|
原 料 |
纯碱(Na2CO3)石灰石(CaCO3)石英(SiO2) |
主要原料 石灰石 粘土 辅助原料 适量的石膏等 |
|
原 理 |
高温下复杂物理化学变化 |
高温下复杂物理化学变化 |
|
化学方程式 |
Na2CO3+SiO2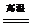 Na2SiO3+CO2 Na2SiO3+CO2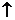 CaCO3+SiO2 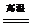 CaSiO3+CO2 CaSiO3+CO2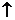 |
|
|
主要成分及特性 |
普通玻璃
钠玻璃(Na2O·CaO·6SiO2)玻璃是非晶体,称为玻璃态物质无固定熔点,在某一温度范围内软化可加工成制品 |
3CaO·SiO2硅酸三钙、2CaO·SiO2硅酸二钙、3CaO·Al2O3铝酸三钙 |
②无机非金属材料:
高温结构陶瓷、生物陶瓷、压电陶瓷等
2、碘容易升华的性质有什么重要用途?
[过渡] 氯、溴和碘的单质除了具有以上物理性质之外,在化学性质方面有哪些相同和不同呢?
[活动探究] 我们已经认识了氯气的强氧化性,请用氯水、溴水、碘水、氯化钠溶液、溴化钠溶液、碘化钾溶液,设计实验探究氯、溴、碘三种单质的氧化性强弱。记录实验现象、实验结论或化学方程式。
你的实验方案与实验记录
|
实验内容 |
实验现象 |
实验结论或化学方程式 |
|
|
|
|
<思考>:1、通过实验探究,你认为氯、溴、碘单质的化学性质有什么共同特点?它们的氧化性强弱如何?写出发生反应的离子反应方程式。