摘要:海水提溴的化学反应原理是什么?工业流程所经历的主要步骤有哪些?
网址:http://m.1010jiajiao.com/timu_id_4435133[举报]
海水提溴的过程是提取NaCl后的浓缩卤水中,通入过量Cl2反应后,用空气吹出溴蒸气,用热碱液吸收后,再加入H2SO4酸化,经蒸馏可得液溴。
(1)浓缩卤水中通入Cl2的离子反应为__________。
(2)用空气吹出Br2并用热碱液吸收的目的和化学反应是__________________。
(3)用H2SO4酸化的原理是___________________。
(4)生产所用Cl2、NaOH的主要来源是___________________。
查看习题详情和答案>>海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.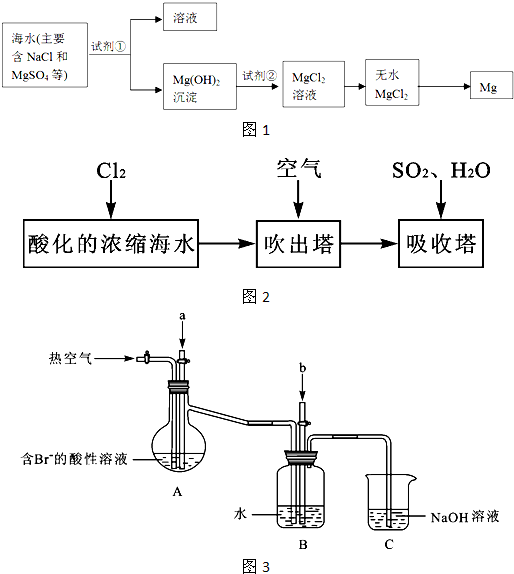
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如图1所示:
①为了使MgSO4转化为Mg(OH)2,试剂①可以选用
②试剂②可以选用
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是
A.Mg(OH)2
MgO
Mg
B.Mg(OH)2
MgO
Mg
C.Mg(OH)2
MgCl2
Mg
D.Mg(OH)2
MgCl2
Mg
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作.工业以浓缩海水为原料提取溴的部分过程如图2所示.
某课外小组在实验室模拟上述过程设计如图3所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示)
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是
③反应过程中,B装置中有SO42-生成.检验SO42-的方法是
④C装置的作用是
查看习题详情和答案>>

(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、
过滤
过滤
、蒸发
蒸发
可制得精盐.(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如图1所示:
①为了使MgSO4转化为Mg(OH)2,试剂①可以选用
氢氧化钠(NaOH)
氢氧化钠(NaOH)
,要使MgSO4完全转化为沉淀,加入试剂①的量应过量
过量
;②试剂②可以选用
盐酸
盐酸
;③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是
C
C
.A.Mg(OH)2
| △ |
| 电解 |
| 2800℃ |
B.Mg(OH)2
| △ |
| C |
| 还原 |
C.Mg(OH)2
| HCl |
| ||
| 714℃ |
D.Mg(OH)2
| HCl |
| 活泼金属 |
| 还原 |
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作.工业以浓缩海水为原料提取溴的部分过程如图2所示.
某课外小组在实验室模拟上述过程设计如图3所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示)
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
;②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是
吹出Br2
吹出Br2
;③反应过程中,B装置中有SO42-生成.检验SO42-的方法是
取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-
取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-
;④C装置的作用是
吸收未反应的Cl2、Br2和SO2
吸收未反应的Cl2、Br2和SO2
.下列有关说法正确的是( )
| A、高温加热氧化镁和碳的混合物可以制单质镁 | B、铁的冶炼过程是通过置换反应得到单质铁 | C、海水提溴的过程中不发生氧化还原反应 | D、利用电解的方法可以从海水中获得淡水 |
(2011?南京模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于
(2)步骤④的离子方程式:
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.若在实验室分离上述混合物的分离仪器的名称是
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
查看习题详情和答案>>

(1)溴在周期表中位于
第四
第四
周期,ⅦA
ⅦA
族.(2)步骤④的离子方程式:
Br2+SO2+2H2O=4H++2Br-+SO42-
Br2+SO2+2H2O=4H++2Br-+SO42-
.(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
.(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.若在实验室分离上述混合物的分离仪器的名称是
分液漏斗
分液漏斗
,分离时液溴从分离器的下口
下口
(填“上口”或“下口”)排出.(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、海水提溴的过程中,没有发生氧化还原反应 | B、海水中的氘(含HDO 0.03%)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同 | C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | D、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |