摘要:(二)知识框架 1.半导体材料与单质硅 ①单质硅的物理性质: ②硅的化学性质:常温下不活泼.除氟气.氢氟酸和强碱外.一般不与其他物质反应.加热条件下.可与氧气反应. Si + O2 加热===== SiO2 Si + 2F2 === SiF4 Si + 4HF === SiF4 ↑+ 2H2↑ ③硅的工业制法: 工业上.用焦炭在电炉中还原SiO2得到含有少量杂质的粗硅后再提纯. SiO2 + 2C 高温===== Si + 2CO↑ ④硅的主要用途:作半导体材料,制造太阳能电池,制造硅合金等. 2.二氧化硅与光导纤维 ①物理性质 ②化学性质 SiO2 + 2NaOH == Na2SiO3 + H2O SiO2 + CaO 高温===== CaSiO3 SiO2 + 4HF == SiF4↑ + 2H2O ③二氧化硅的用途:制造电子元器件.光学仪器.精密仪器轴承.光导纤维.石英钟.工艺品.玻璃等. 3.硅酸盐与无机非金属材料 ①玻璃.水泥 玻 璃 水 泥 原 料 纯碱(Na2CO3)石灰石(CaCO3)石英(SiO2) 主要原料 石灰石 粘土 辅助原料 适量的石膏等 原 理 高温下复杂物理化学变化 高温下复杂物理化学变化 化学方程式 Na2CO3+SiO2Na2SiO3+CO2 CaCO3+SiO2CaSiO3+CO2 主要成分及特性 普通玻璃 钠玻璃(Na2O·CaO·6SiO2)玻璃是非晶体.称为玻璃态物质无固定熔点.在某一温度范围内软化可加工成制品 3CaO·SiO2硅酸三钙.2CaO·SiO2硅酸二钙.3CaO·Al2O3铝酸三钙 ②无机非金属材料: 高温结构陶瓷.生物陶瓷.压电陶瓷等
网址:http://m.1010jiajiao.com/timu_id_4435137[举报]
下面是关于药物华素片(西地碘片)使用说明书的部分内容。
华素片(西地碘片)使用说明书
[品名和组成]
品名:西地碘片
商品名:华素片
英文名:Gydiodine tablets
华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。
[贮藏]遮光、密闭、在阴凉处保存。
[有效期]二年
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是__________(写分子式)。
②请推断华素片__________(“是”或“不是”)白色的。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中加入约1.5 mL __________(填选项字母),并用力振荡。
A.酒精
B.热裂汽油
C.四氯化碳
D.甘油
②描述加入该液体后可能观察到的现象____________________。
(3)请再设计另一种方法,验证华素片中的成分。(注意叙述实验操作方法和实验结论)
查看习题详情和答案>>(2010?和平区一模)(Ⅰ)食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7C00H]含量很低.下列关于亚油酸的说法中,正确的是
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.不能使酸性KMnO4溶液褪色
(Ⅱ)香精( )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
已知:A具有两种一氯代物B和C

回答下列问题:
(1)和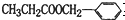 互为同分异构体的是
互为同分异构体的是

(2)D物质的名称为
(3)高分子F的结构简式为
 ;
;
(4)写出H和I反应生成三酯的化学方程式: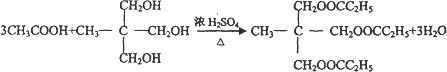
 .
.
查看习题详情和答案>>
(1)聚偏二氯乙烯(
 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2
CCl2=CH2
(写结构简式)发生加聚反应生成的.(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7C00H]含量很低.下列关于亚油酸的说法中,正确的是
BC
BC
(填序号).A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.不能使酸性KMnO4溶液褪色
(Ⅱ)香精(
 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.已知:A具有两种一氯代物B和C

回答下列问题:
(1)和
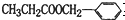 互为同分异构体的是
互为同分异构体的是①②④
①②④
(填序号).
(2)D物质的名称为
1,2-二溴丙烷
1,2-二溴丙烷
.(3)高分子F的结构简式为


(4)写出H和I反应生成三酯的化学方程式:


下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
(1)最活泼的金属元素是
(2)②和⑤两种元素原子半径较大的是
(3)写出①的单质在⑥的单质中燃烧的化学方程式式
查看习题详情和答案>>
| 主族 周期 |
ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | |||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ||||
Na
Na
(填元素符号)(2)②和⑤两种元素原子半径较大的是
Si
Si
(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是Cl
Cl
(填元素符号);(3)写出①的单质在⑥的单质中燃烧的化学方程式式
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
下表是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为
 .
.
(2)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n=
(3)B具有的性质是
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色.
查看习题详情和答案>>
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 |
①由C、H两种元素组成 ②分子球棍模型为  |
(1)A与溴的四氯化碳溶液反应的生成物的名称为
1,2-二溴乙烷
1,2-二溴乙烷
;写出在一定条件下,A发生聚合反应生成高分子

(2)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n=
4
4
,x=8
8
.(3)B具有的性质是
②③⑦
②③⑦
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色.
下表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=
(3)B具有的性质是
 .
.
(4)写出由C与D的反应生成相对分子质量为100的酯的化学反应方程式:
查看习题详情和答案>>
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
①相对分子质量比C少2; ②能由C氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
1,2-二溴乙烷
1,2-二溴乙烷
;(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=
4
4
时,这类有机物开始出现同分异构体.(3)B具有的性质是
②③
②③
(填编号):①无色无味液体 ②有毒 ③不溶于水 ④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:

(4)写出由C与D的反应生成相对分子质量为100的酯的化学反应方程式:
CH2=CH-COOH+CH3CH2OH
CH2=CH-COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH2=CH-COOH+CH3CH2OH
CH2=CH-COOCH2CH3+H2O
.| 浓硫酸 |
| △ |