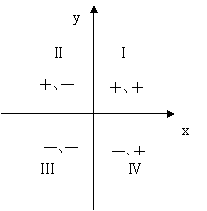2.第Ⅱ象限符号为“+、-”(△S>0、△H<0)时化学反应的方向--所有温度下反应均能自发进行
[例2]已知双氧水、水在298K、100kPa时的标准摩尔生成焓的数据如下:
|
物 质 |
△fH /kJ·mol-1 /kJ·mol-1 |
|
H2O(l) |
-258.8 |
|
H2O2(l) |
-191.2 |
|
O2(g) |
0 |
(1)试由以上数据计算双氧水发生分解反应的热效应。
(2)若双氧水发生分解反应生成液态水和氧气时,其△S==57.16J·mol-1·K-1
试判断该反应在常温下能否自发进行。若温度达到2000K时,反应能否自发进行。
[解析]
(1)根据△H ==H(产物)-H(反应物)得,△H ==2×(-258.8kJ·mol-1)+0-2×(-191.2kJ·mol-1)=== -135.2kJ·mol-1。
(2)在298K时,△H-T△S=-135.2kJ·mol-1-(298K×10-3×57.16kJ·mol-1·K-1) == -152.23 kJ·mol-1<0
∴该反应在常温下可自发进行。
温度达到2000K,且假定焓变和熵变不随温度变化而变化,△H-T△S=-135.2kJ·mol-1-(2000K×10-3×57.16kJ·mol-1·K-1)== -249.52kJ·mol-1<0
故△S>0、△H<0时,仅从符号上进行分析,无论温度如何变化,恒有△H-T△S<0,故化学反应的方向--所有温度下反应均能自发进行。
4.活化能:对基元反应而言,活化分子的平均能量与普通反应物分子的平均能量之差叫该反应的活化能(用Ea表示,其单位为kJ/mol)。活化能越大,反应越难进行。
催化剂能降低化学反应的活化能,增大活化分子的百分数,进而增大化学反应速率。催化剂具有选择性。
解释化学反应速率快慢的链条思维:活化能→活化分子→有效碰撞→化学反应速率。
 影响 影响外因 |
单位体积内 |
有效碰撞次数 |
化学反应速率 |
||
|
分子总数 |
活化分子数 |
活化分子百分数 |
|||
|
增大反应物浓度 |
增加 |
增加 |
不变 |
增加 |
加快 |
|
增大压强 |
增加 |
增加 |
不变 |
增加 |
加快 |
|
升高温度 |
不变 |
增加 |
增大 |
增加 |
加快 |
|
使用催化剂 |
不变 |
增加 |
增大 |
增加 |
加快 |
|

[例1](2010福建卷,12) 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是

A 2.5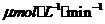 和2.0
和2.0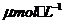
B 2.5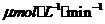 和2.5
和2.5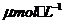
C 3.0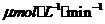 和3.0
和3.0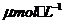
D 3.0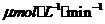 和3.0
和3.0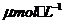
解析:本题考察化学反应速率的计算
第8秒与第4秒时反应物浓度差△C为10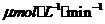 ,
,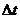 为4秒,所以在4~8
为4秒,所以在4~8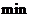 间的平均反应速率为2.5
间的平均反应速率为2.5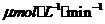 ,可以排除CD两个答案;图中从0
,可以排除CD两个答案;图中从0 开始到8
开始到8 反应物浓度减低了4倍,根据这一幅度,可以推测从第8
反应物浓度减低了4倍,根据这一幅度,可以推测从第8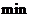 到第16分也降低4倍,即由10
到第16分也降低4倍,即由10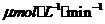 降低到2.5
降低到2.5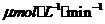 ,因此推测第16
,因此推测第16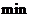 反应物的浓度为2.5
反应物的浓度为2.5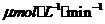 ,所以可以排除A而选B
,所以可以排除A而选B
答案:B
[例2](2010全国卷1,27)
(15分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为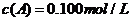 、
、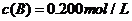 及
及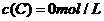 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
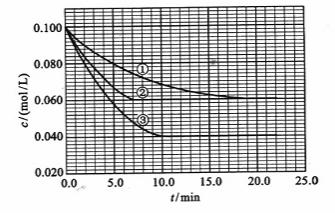
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的 __
__ _______0,判断其理由是__________________________________;
_______0,判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: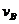 =__________________________________;
=__________________________________;
实验③: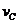 =__________________________________。
=__________________________________。
[解析](1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的
(2)不妨令溶液为1L,则②中达平衡时A转化了0.04mol,由反应计量数可知B转化了0.08mol,所以B转化率为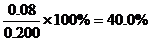 ;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
(3)  ﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,
﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应, ﹥0
﹥0
(4)从图上读数,进行到4.0min时,实验②的A的浓度为:0.072mol/L,则△C(A)=0.10-0.072=0.028mol/L,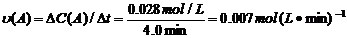 ,∴
,∴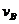 =2
=2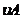 =0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L,
=0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,)
=0.10-0.064=0.036mol/L,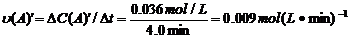 ,∴
,∴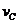 =
=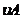 =0.0089mol(L·min)-1
=0.0089mol(L·min)-1
[答案](1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;(3)﹥;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
[命题意图]考查基本理论中的化学反应速率化学平衡部分,一些具体考点是:易通过图像分析比较得出影响化学反应速率和化学平衡的具体因素(如:浓度,压强,温度,催化剂等)、反应速率的计算、平衡转化率的计算,平衡浓度的计算, 的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
[点评]本题所涉及的化学知识非常基础,但是能力要求非常高,观察和分析不到位,就不能准确的表述和计算,要想此题得满分必须非常优秀才行!此题与2009年全国卷II理综第27题,及安微卷理 综第28题都极为相似,有异曲同工之妙,所以对考生不陌生!
综第28题都极为相似,有异曲同工之妙,所以对考生不陌生!
|

第2课时 化学反应的方向及判据
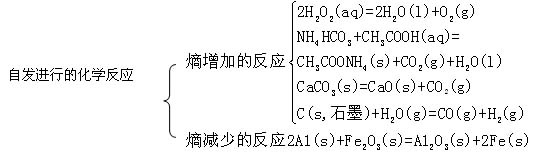
 反应放热和熵增加都有利于反应自发进行。该判据指出的是化学反应自发进行的趋势。
反应放热和熵增加都有利于反应自发进行。该判据指出的是化学反应自发进行的趋势。