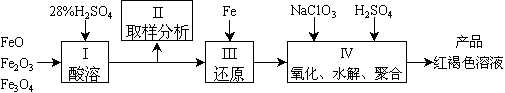
26.(A)如上图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。回答下列问题:
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20 mL H2S |
10 mL SO2 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mol Cl2 |
40 mL NH3 |
|
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________
(2)实验2甲针筒内的现象是:有__________生成,活塞_____移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入 溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_____,写出NO2与H2O反应的化学方程式_________________________________
(4)实验4中,已知:3Cl2+2NH3¾®N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为__________,最后针筒中剩余气体的体积约为_____mL。
27.将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
CaSO4·2H2O
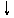
|
|
|
|
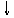
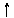


 H2O¾®
H2O¾®
|
|
|
|


 H2O¾®
H2O¾®
CaCl2·6H2O K2SO4
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要__________________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
___________________________________________________________
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有__________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有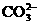 的方法是:________
_______________________________________
的方法是:________
_______________________________________
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
|
温度(℃) |
0 |
20 |
60 |
|
K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591 g冷却到0℃,可析出K2SO4晶体_____g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____
A.熔点较低(29℃熔化) B.能导电 C.能制冷 D.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________
2008年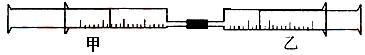
27.
 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下: HCl
Ca(OH)2 Ca(OH)2
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下: HCl
Ca(OH)2 Ca(OH)2
 蛇纹石¾®溶解(pH<1)¾® I
¾®
II ¾®Mg(HCO3)2(热解)¾®碱式碳酸镁
蛇纹石¾®溶解(pH<1)¾® I
¾®
II ¾®Mg(HCO3)2(热解)¾®碱式碳酸镁
SiO2¯ 沉淀物A CO2 沉淀物B
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
|
会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入__________(填化学式),然后________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
① 样品称量,② 高温分解,③ _______________,④ _______________,⑤ MgO称量。
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=_____,b=_____,c=_____。
2007年
 根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。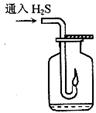
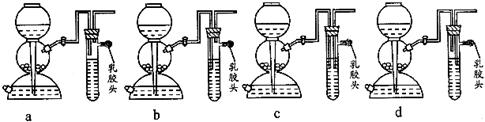
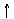 沉淀物¾®溶解¾®过滤¾®水解¾®过滤¾®氢氧化铝
沉淀物¾®溶解¾®过滤¾®水解¾®过滤¾®氢氧化铝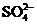 外,还有大量的
外,还有大量的 。检验
。检验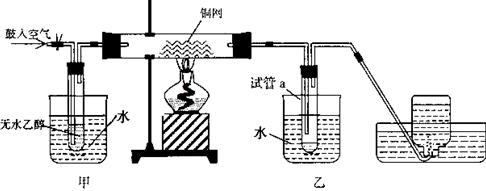
 制取N2
制取N2 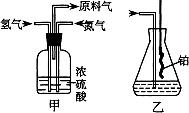 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有____________、____________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有____________、____________。
 (B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: ¾¾¾¾途径I¾¾¾¾
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为: ¾¾¾¾途径I¾¾¾¾ 杂铜¾®粗制氧化铜
硫酸铜溶液¾®胆矾(CuSO4·H2O)
杂铜¾®粗制氧化铜
硫酸铜溶液¾®胆矾(CuSO4·H2O)
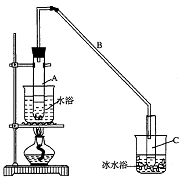
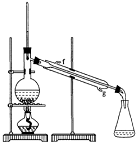 ① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用_____洗涤。
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填:上、下),分液后用_____洗涤。