填空并完成表格
|
内容 |
同周期(从左到右) |
同主族(从上到下) |
|
实例 |
第三周期元素(除了Ar) |
碱金属元素、卤族元素 |
|
原子半径 |
逐渐 |
逐渐 |
|
电子层结构 |
相同 递增 |
递增 相同 |
|
失电子能力 得电子能力 |
逐渐 逐渐 |
逐渐 逐渐 |
|
金属性 非金属性 |
逐渐 逐渐 |
逐渐 逐渐 |
|
主要化合价 |
最高正价: → 非金属负价: → |
主族最高正价数= |
|
最高价氧化物对应水化物的酸碱性 |
酸性逐渐 碱性逐渐 |
酸性逐渐 碱性逐渐 |
|
非金属元素气态氢化物的形成与稳定性 |
气态氢化物的形成逐渐 气态氢化物逐渐 |
气态氢化物的形成逐渐 气态氢化物逐渐 |
4、金属、非金属在元素周期表中的位置及其性质递变的规律
(1)判断元素金属性和非金属性强弱的方法:
元素的金属性判断:①元素的金属性越强,其单质越容易与水(或酸)反应置换出氢气;②它们的最高价氧化物的水化物-氢氧化物碱性越强。③金属性强的金属可以置换出金属性弱的金属 ④原电池中作负极的金属比作正极的金属的金属性强⑤元素周期表左下角的金属金属性最强
元素非金属性判断:
①元素的非金属性越强,其单质越容易与氢气反应,生成的氢化物越稳定;②非金属性越强,它们的最高价氧化物的水化物的酸性越强。③非金属性强的物质可以把非金属弱的物质置换出来。④元素周期表右上角的非金属的非金属性最强
(2)周期表中的最
在整个周期表中,金属性最强的元素是 ,非金属性最强的元素是 ,常温下液态的金属单质是 ,液态的非金属单质是 ,碱性最强的碱是 ,含氧酸酸性最强的酸是 ,原子半径最大的元素是 ,氢化物最稳定的元素是 ,没有正价的非金属元素是 ,在金属和非金属交界处,能够找到作为 的元素,你所知道的半导体有 。
[课堂复习]
知识点1、了解元素周期律的实质。了解元素周期表(长式)的结构(周期、族)。
例1、元素的性质随着原子序数的递增呈现周期性变化的根本原因是:
A.元素相对原子质量的递增而引起的变化
B.元素的化合价呈周期性的变化
C.元素原子核外电子排布呈周期性的变化
D.元素的金属性和非金属性呈周期性变
例2、主族元素在周期表的位置,取决于元素原子的
A.相对原子质量和核电荷数 B.电子层数和质子数。
C.电子层数和最外层电子数 D.金属性和非金属的强弱。
例3、已知某元素原子的L电子层上有6个电子,则该元素在周期表中位于:
A.第3周期IVA族 B.第2周期VIA族
C.第2周期IVA族 D.第3周期VIA族
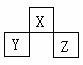 例4、短周期元素X、Y、Z的位置如下图所示,已知Y、Z两元素原子序数之和
例4、短周期元素X、Y、Z的位置如下图所示,已知Y、Z两元素原子序数之和
是X原子序数的4倍。X、Y、Z三元素的元素符号是
A.N、Si、S B。O、P、C1 C、F、S、Ar D、C、A1、P
知识点2、以第3周期、IA和ⅦA族为例了解同周期、同主族元素性质的递变规律与原子结构的关系。
例5、X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是:
A.X原子的电子层数比Y原子的电子层数多
B.X的半径比Y的半径大;
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来。
例6、下列事实不能用来判断金属性强弱的是
A.金属间发生的置换反应
B.1mol金属单质在反应中失去电子的多少
C.金属间的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水或酸反应置换出氢气的难易程度
例7、下列气态氢化物最稳定的是
A.SiH4 B.PH3 C.H2S D.HCl
例8、下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
例9、下列各组性质的比较中正确的是:
A.酸性 HClO4<HBrO4<HIO4 B.碱性强弱: KOH > NaOH > LiOH
C.稳定性 HCl>PH3>H2S D.氧化性: I2>Br2>Cl2
例10、碲(Te)为第五周期,ⅥA族元素,它的化合物是一种常用的VCD光盘记录材料。下列有关该元素的叙述中,正确的是:
A.非金属性:S > Te B.气态氢化物稳定性:H2S > H2Te
C.原子半径:S > Te D.酸性: H2SO4 < H2TeO4
知识点3、了解金属、非金属在元素周期表中的位置及其性质递变的规律。
例11、元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A 左、下方区域的金属元素
B 金属元素和非金属元素分界线附近的元素
C 右、上方区域的非金属元素
D 稀有气体元素
例12、锗(Ge)是第四周期第 ⅣA 元素,处于周期表中金属区与非金属区的交界线上,下列叙述不正确的是
A.锗的金属性比钙弱 B.锗化氢(GeH4)稳定性很强
C.氢氧化锗可能具有两性 D.锗的金属性比铅弱
[记记背背]元素周期表中的化学之最
(1)整体结构
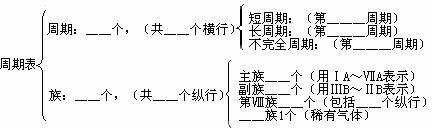
(2)周期表的横向(周期)
|
类别 |
周期序数 |
起止元素 |
包括元素种数 |
核外电子层数 |
稀有气体原子序数 |
|
____周期 |
1 |
H-He |
|
|
|
|
2 |
Li-Ne |
|
|
|
|
|
3 |
Na-Ar |
|
|
|
|
|
____周期 |
4 |
K-Kr |
|
|
|
|
5 |
Rb-Xe |
|
|
|
|
|
6 |
Cs-Rn |
|
|
|
|
|
____周期 |
7 |
Fr-112号 |
|
|
|
(3)周期表的纵向(填写族序数)。
 族
族
周期
 ,反应前后,没有发生变化的是
,反应前后,没有发生变化的是 从右图的溶解度曲线图,可获得的信息是
从右图的溶解度曲线图,可获得的信息是