摘要:(1)整体结构 类别 周期序数 起止元素 包括元素种数 核外电子层数 稀有气体原子序数 周期 1 H-He 2 Li-Ne 3 Na-Ar 周期 4 K-Kr 5 Rb-Xe 6 Cs-Rn 周期 7 Fr-112号 (3)周期表的纵向. 族 周期 1 H He 2 Be B C N O F 3 4 Sc Ti V Cr Mn Fe Co Ni Cu Zn
网址:http://m.1010jiajiao.com/timu3_id_66813[举报]
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为
(2)画出d元素原子的结构示意图
 ,其气态氢化物溶于水显
,其气态氢化物溶于水显
(3)比较元素g和元素h形成的最高价氧化物的水化物的碱性强弱
(4)表中j元素在元素周期表中的位置是
(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是
查看习题详情和答案>>
| a | b | ||||||||||||||||
| c | d | e | f | ||||||||||||||
| g | h | i | j | m | |||||||||||||
| n | o | ||||||||||||||||
(1)表中所列元素中,原子最外层有2个电子的元素为
h
h
.(2)画出d元素原子的结构示意图


碱
碱
性.(填“酸”或“碱”)(3)比较元素g和元素h形成的最高价氧化物的水化物的碱性强弱
NaOH
NaOH
>Mg(OH)2
Mg(OH)2
.(4)表中j元素在元素周期表中的位置是
第三周期第ⅤA族
第三周期第ⅤA族
.(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是
NaOH
NaOH
(填写化合物的化学式,下同),具有两性的是Al(OH)3
Al(OH)3
.硅单质及其化合物应用范围很广.三氯硅烷(SiHCl3)还原法是目前工业制高纯度硅的主要方法,生产过程如下图:

根据题意完成下列备题:
(1)硅在元素周期表的位置 ,其最外层有 种能量不同的电子.
(2)硅的气态氢化物为SiH4,其空间构型为 ;三氯硅烷中某些元素最高价氧化物对应水化物的酸性 > (填化学式).
(3)写出三氯硅烷与氢气反应的化学反应方程式: .
(4)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KALSi3O8),氧化物形式为: .
查看习题详情和答案>>

根据题意完成下列备题:
(1)硅在元素周期表的位置
(2)硅的气态氢化物为SiH4,其空间构型为
(3)写出三氯硅烷与氢气反应的化学反应方程式:
(4)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KALSi3O8),氧化物形式为:
下表为元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意简图为
 ;
;
(2)表中能形成两性氢氧化物的元素是
(3)①、②、⑦、⑧四种元素的最高价氧化物对应水化物中酸性最强的是
(4)③元素和(11)元素两者的核电荷数之差是
(5)④、⑤两元素相比较,金属性较强的是
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素气态氢化物的稳定性
(6)高性能的现代通讯材料--光导纤维是
(7)③与⑩能形成
(8)⑩的单质与水反应的化学方程式
用洁净的铂丝棒蘸取上述反应后的溶液在酒精灯上灼烧,能够观察到
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ | (11) |


(2)表中能形成两性氢氧化物的元素是
Al
Al
(用元素符号表示),写出该氢氧化物与⑩的最高正价氧化物对应水化物反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O
Al(OH)3+KOH=KAlO2+2H2O
;(3)①、②、⑦、⑧四种元素的最高价氧化物对应水化物中酸性最强的是
HClO4
HClO4
(用化学式表示);(4)③元素和(11)元素两者的核电荷数之差是
26
26
;(5)④、⑤两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该实验结论的实验是B C
B C
.A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素气态氢化物的稳定性
(6)高性能的现代通讯材料--光导纤维是
⑥
⑥
(填编号)的氧化物制造出来的.写出该氧化物和氢氧化钠溶液反应的化学方程式SiO2+2NaOH═Na2SiO3+H2O
SiO2+2NaOH═Na2SiO3+H2O
.(7)③与⑩能形成
离子
离子
(填:“离子”或“共价”)化合物.(8)⑩的单质与水反应的化学方程式
2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
.用洁净的铂丝棒蘸取上述反应后的溶液在酒精灯上灼烧,能够观察到
紫
紫
色火焰.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相关信息,利用下表回答相关问题
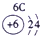
(1)请画出16号元素原子结构示意图 化学反应中该原子比较容易 (填“得到”或“失去”)电子变成离子;
(2) 表示的是 (填离子符号);
表示的是 (填离子符号);
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是 (填化学式,任意填写一种);
(4)上表中第二、三周期元素最外层电子数的变化规律是 .
查看习题详情和答案>>
| 第一周期 | 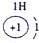 |
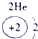 | ||||||
| 第二周期 | 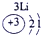 |
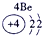 |
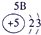 |
 |
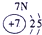 |
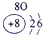 |
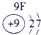 |
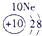 |
| 第三周期 | 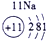 |
 |
 |
 |
 |
 | ||
(2)
 表示的是
表示的是(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是
(4)上表中第二、三周期元素最外层电子数的变化规律是
(2013?红桥区一模)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质B的组成元素在周期表中的位置是
(2)戊的化学式为
(3)NaClO的电子式为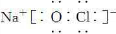
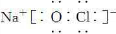 .
.
(4)甲与水反应的化学方程式为
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
查看习题详情和答案>>

请回答:
(1)单质B的组成元素在周期表中的位置是
第2周期第ⅤA族
第2周期第ⅤA族
.(2)戊的化学式为
Al(OH)3
Al(OH)3
.戊与强碱反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)NaClO的电子式为
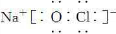
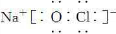
(4)甲与水反应的化学方程式为
AlN+3H2O=Al(OH)3↓+NH3↑
AlN+3H2O=Al(OH)3↓+NH3↑
.(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:
2NH3+NaClO═N2H4+NaCl+H2O
2NH3+NaClO═N2H4+NaCl+H2O
.(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
.