摘要:16g氢氧化钠溶于一定量水中得到200mL溶液.则该溶液的物质的量浓度为( ) A.1mol/L B.2mol/L C.3mol/L D.3.6mol/L
网址:http://m.1010jiajiao.com/timu3_id_59294[举报]
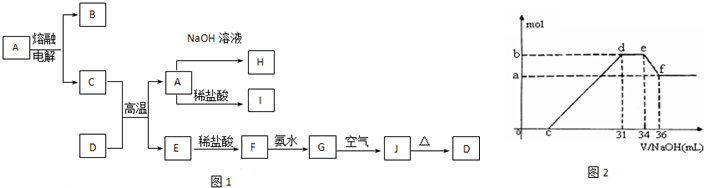
A-J是中学化学中常见的物质,它们之间的转化关系如框图1所示(部分产物已略去).已知A是一种高熔点物质,J是一种红褐色沉淀.请回答下列问题:
(1)A的化学式为
(2)H溶液中通入过量的CO2,其反应的离子方程式是
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
上述现象说明溶液中
③b与a的差值为
查看习题详情和答案>>
(1)A的化学式为
Al2O3
Al2O3
(2)H溶液中通入过量的CO2,其反应的离子方程式是
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
G→J的化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
H++OH-=H2O
H++OH-=H2O
.②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
;上述现象说明溶液中
H+
H+
结合OHˉ的能力最强(填离子符号).③b与a的差值为
0.008mol
0.008mol
mol.
(2012?江苏一模)锂/磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,其制备方法如下:称取适量的Na3PO4?12H2O和CuSO4?5H2O分别溶解在蒸馏水中,充分搅拌,转入反应釜中,调节溶液pH为7~9,密封,放入130°烘箱中反应4h.自然冷却到室温,过滤,所得沉淀分别用蒸馏水和乙醇洗涤数次,干燥,得到产品.反应原理为:
2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)用蒸馏水洗涤时,检验洗涤是否完全的方法是
(2)电池放电时,负极锂转化为Li2O,正极磷酸铜转变为Cu和Li3PO4,写出该电池反应的方程式
(3)准确称取上述样品1.928g[假定只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量硝酸中,再加氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为1.360g.计算得样品中磷酸氧铜(摩尔质量为:462g/mol)的质量分数(写出简要计算过程和结果)
查看习题详情和答案>>
2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)用蒸馏水洗涤时,检验洗涤是否完全的方法是
取最后一次洗涤的流出液,向其中加入氯化钡溶液,若无白色沉淀,说明已经洗涤干净
取最后一次洗涤的流出液,向其中加入氯化钡溶液,若无白色沉淀,说明已经洗涤干净
;最后用乙醇洗涤的目的是快速干燥固体
快速干燥固体
.(2)电池放电时,负极锂转化为Li2O,正极磷酸铜转变为Cu和Li3PO4,写出该电池反应的方程式
Cu4O(PO4)2+8Li=4Cu+Li2O+2Li3PO4
Cu4O(PO4)2+8Li=4Cu+Li2O+2Li3PO4
.(3)准确称取上述样品1.928g[假定只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量硝酸中,再加氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为1.360g.计算得样品中磷酸氧铜(摩尔质量为:462g/mol)的质量分数(写出简要计算过程和结果)
A-J是中学化学中常见的物质,它们之间的转化关系如下框图1所示(部分产物已略去).已知A是一种高熔点物质,J是一种红褐色沉淀.

请回答下列问题:
(1)A的化学式为 .
(2)H与I溶液混合后,发生反应的离子方程式是 .G→J的化学方程式为 .
(3)D物质恰好溶于一定量的稀盐酸后,所得溶液显酸性的原因(用方程式表示) .
(4)实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低.某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如图2所示.试回答下列问题:
①图2中OC段没有沉淀生成,此阶段发生的离子方程式为: .
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为: ;
③B点对应的沉淀量为 mol,C点对应的横坐标为 mol.
查看习题详情和答案>>

请回答下列问题:
(1)A的化学式为
(2)H与I溶液混合后,发生反应的离子方程式是
(3)D物质恰好溶于一定量的稀盐酸后,所得溶液显酸性的原因(用方程式表示)
(4)实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低.某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如图2所示.试回答下列问题:
①图2中OC段没有沉淀生成,此阶段发生的离子方程式为:
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:
③B点对应的沉淀量为
(14分)A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 。
(2)H与I溶液混合后,发生反应的离子方程式是 。
G→J的化学方程式为 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性原因 。
(4) 实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低。某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如左图所示。试回答下列问题:
①图中OC段没有沉淀生成,此阶段发生的离子方程式为:_______________________________。
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:_________________________________;
③B点对应的沉淀量为________________ mol,C点对应的横坐标为___________mol。