网址:http://m.1010jiajiao.com/timu3_id_59292[举报]
(浙江舟山中学2009届度第一学期高三期中考试,化学,15)能将分别含有Cu2 +、Fe3+、Al3+、Fe2+、Mg2+、NH4+、Na+等离子的七种溶液一次鉴别出来的试剂是
A.NaHCO3溶液 B. KSCN溶液 C.NaOH溶液 D. NH3·H2O溶液
查看习题详情和答案>>(福建省漳州市芗城中学2009届高三一轮复习单元测试,化学,3)实验室配制1mol·L-1盐酸250mL,下列不需用的仪器是
A.250 mL容量瓶 B.托盘天平 C.胶头滴管 D.烧杯
查看习题详情和答案>>(浙江舟山中学2009届度第一学期高三期中考试,化学,24)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
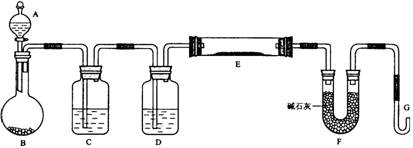
请回答下列问题。
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是:
____________________。在这两步之间还应进行的操作是_____________________;
(4)反应过程中G管逸出的气体是________________,其处理方法是:
______________________________________________________________________。
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
查看习题详情和答案>>