2、共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436KJ/mol,是指1molH2分子变成2molH原子需要吸收436KJ的能量。你认为下列分子中的共价键能量最大的是( )
A、HF B、HCl C、HBr D、HI
3、关于氢键,下列说法正确的是( )
A、每一个水分子内含有两个氢键 B、冰和水中都存在氢键
C、DNA中的碱基互补配对是通过氢键实现的 D、水是一种非常稳定的化合物,是由于氢键所致
4、当干冰熔化或气化时,下列各项中发生变化的是( )
A、分子内化学键 B、分子间距离
C、分子构型 D、分子间作用力
5、下列微粒中,含有孤对电子的是(
)
A、SiH4 B、CH4 C、H2O D、NH4+
6、下列说法中不正确的是:
A、化学键可分为离子键、共价键、极性键、非极性键四类
B、共价键可分为极性键和非极性键两类
C、共价键可分为σ键和π键两类
D、共价键可分为单键、双键和叁键三类
7、下列物质的杂化方式不是sp3杂化的是(
)
A、CO2 B、CH4
C、NH3 D、H2O
8、下列物质中,难溶于CCl4的是(
)
A、碘单质 B、 水 C、 苯 D、甲烷
9、下列说法中正确的是( )
A、分子中键能越大,键长越长,则分子越稳定
B、失电子难的原子获得电子的能力一定强
C、在化学反应中,某元素由化合态变为游离态,该元素被还原
D、电子层结构相同的不同离子,其半径随核电荷数增多而减小
10、下列不属于配合物的是( )
A、[Cu(H2O)4]SO4·H2O B、[Ag(NH3)2]OH
C、KAl(SO4)2·12H2O D、Na[Al(OH)4]
11、下列不是等电子体的是( )
A、N2O和CO2 B、O3和NO2-
C、CH4和NH4+ D、OH-和NH2-
12、下列分子或离子中不能跟质子结合的是(
)
A、NH3 B、H2O
C、Ca2+ D、NH4+
13、用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是
( )
A、苯 B、二硫化碳
C、氯水 D、四氯化碳
14、下列物质的分子中,π键最多的是( )
A、N2 B、Cl2 C、CO2
D、SO3
15、下列化学式中,能真实表示物质的分子组成的是(
)
A、CuSO4 B、CS2 C、Ar D、CsCl
16下列各组分子中,都属于含极性键的非极性分子的是 ( )
A、CO2 H2S B、C2H4 CH4 C、C60 C2H4
D、NH3 HCl
17、“神舟六号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为_________________
。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式___________________________________。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式:___________________________。
18、有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN(H-C N)
只含有极性键的是________________;只含有非极性键的是________________;既含有极性键的是又含有非极性键的是________________;只有δ键的是________________,既有δ键,又有π键的是_______________;含有由两个原子的s轨道重叠形成的σ键的是__________________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的δ键的是__________________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________________。
19、试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
20、将几种分子晶体在水和四氯化碳中的溶解情况填入下表:
N)
只含有极性键的是________________;只含有非极性键的是________________;既含有极性键的是又含有非极性键的是________________;只有δ键的是________________,既有δ键,又有π键的是_______________;含有由两个原子的s轨道重叠形成的σ键的是__________________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的δ键的是__________________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________________。
19、试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
20、将几种分子晶体在水和四氯化碳中的溶解情况填入下表:
|
|
蔗糖 |
磷酸 |
碘 |
萘 |
|
水 |
|
|
|
|
|
四氯化碳
|
|
|
|
|
其原因是__________________。 21、 (1)在配合物Ni(CO)4 和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________、___________、_____________。 (2)根据VSEPR模型,H3O+的分子立体结构为:___________,BCl3的立体结构为:______________。 (3)按要求写出第二周期非金属元素构成的中性分子的化学式:(只需写一种) 平面三角形分子________________,三角锥形分子_________________________。
2010届高三化学基础达标测试:分子结构与性质(A卷)
11、下列说法中,正确的是( )
A、由分子构成的物质中一定含有共价键
B、离子化合物中一定含有金属元素
C、正四面体结构的分子中的键角一定是109°28′
D、不同的原子的化学性质可能相同
12、下列说法中正确的是( )
A、N- C的键长比N-N的键长小 B、H2O键角是180°,NH3是平面三角形
C、H-H比H-F键长短,所以H-H键键能大 D、C=C键键能比C-C键大,所以乙烯比乙烷更稳定
13、在BrCH=CHBr分子中,C-Br键采用的成键轨道是( )
A、sp-p B、sp2-s C、sp2-p D、sp3-p
14、下列氢键从强到弱的顺序正确的是( )
①O-H…O
②N-H…N
③F-H…F
④O-H…N
A、①②③④ B、③①④② C、③②④① D、③④①②
15、下列说法正确的是( )
A、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
B、离子化合物中只有离子键,共价化合物中只有共价键
C、铵根离子呈正四面体结构
D、氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键
16、三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型的叙述,不正确的是
( )
A、PCl3分子中三个共价键的键长,键角都相等 B、PCl3分子中的P-Cl键属于极性共价键
C、PCl3分子中三个共价键键能,键角均相等
D、PCl3是非极性分子
17、两种非金属元素A、B所形成的下列分子中属于非极性分子的是( )
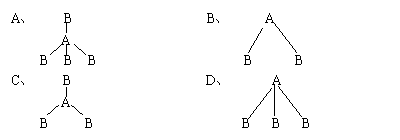 18、关于原子轨道的说法正确的是( )
A 、凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B 、CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C 、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D 、凡AB3型的共价化合物,其中心原子A均采取sp3杂化轨道成键
19、下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2 (X代表卤素原子):
18、关于原子轨道的说法正确的是( )
A 、凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B 、CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C 、sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D 、凡AB3型的共价化合物,其中心原子A均采取sp3杂化轨道成键
19、下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2 (X代表卤素原子):
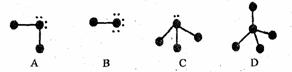 回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比________________(填“相同”或“不相同”),其原因是 ________________________________________ 。
(3)写出上述物质中的两种间相互反应生成离子化合物的化学方程式:__________________ 。
20、水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知2H2O=H3O++OH-,H3O+的立体构型是______________________________,中心原子的杂化类型是__________________。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是( )
A、极性键 B、非极性键 C、配位键
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为__________________ 。
(4)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是(
)
A、金刚石 B、干冰 C、食盐 D、固态氮
21、PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小;另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构?
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:__________________,
黄绿色固体:__________________。
⑶淡黄色固体物质是由________________分子组成,黄绿色固体物质是由________________分子组成(填“极性分子”或“非极性分子”)。
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是__________________。
22、判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强。含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比________________(填“相同”或“不相同”),其原因是 ________________________________________ 。
(3)写出上述物质中的两种间相互反应生成离子化合物的化学方程式:__________________ 。
20、水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知2H2O=H3O++OH-,H3O+的立体构型是______________________________,中心原子的杂化类型是__________________。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是( )
A、极性键 B、非极性键 C、配位键
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为__________________ 。
(4)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是(
)
A、金刚石 B、干冰 C、食盐 D、固态氮
21、PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小;另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构?
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:__________________,
黄绿色固体:__________________。
⑶淡黄色固体物质是由________________分子组成,黄绿色固体物质是由________________分子组成(填“极性分子”或“非极性分子”)。
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是__________________。
22、判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强。含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
|
名称 |
次氯酸 |
磷酸 |
硫酸 |
高氯酸 |
|
结构式 |
Cl-OH |
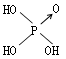 |
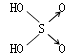 |
 |
|
非羟基氧原子数
|
0 |
1 |
2 |
3 |
|
酸性 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸, H3AsO3既有弱酸性又有弱碱性。由此可推断它们的结构式分别为:①___________②____________ (2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是 ①__________________②__________________。 (3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:__________________。 NF3
2010届高三化学基础达标测试:分子结构与性质(B卷)
1、σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是( ) A、H2 B、HCl C、Cl2 D、N2 2、溴化氢气体的热分解温度比碘化氢热分解温度高的原因是( ) A、溴化氢分子中的键长比碘化氢分子中的键长短,键能大 B、溴化氢分子中的键长比碘化氢分子中的键长长,键能小 C、溴化氢分子相对分子质量比碘化氢分子相对分子质量小 D、溴化氢分子间作用力比碘化氢分子间作用力大。 3、下列说法正确的是: A、有机物CH2=CH-CH3中其杂化类型有sp3 和sp2,其中有两个π键,7个σ键 B、分子CO和N2的原子总数相同,价电子总数相等,故性质相似 C、Na+的电子排布式为1s22s22p63s1 D、CO2分子的结构VSEPR模型是直线形 4、下列物质的性质与氢键无关的是( ) A、冰的密度比液态水的密度小
B、NH3易液化 C、NH3分子比PH3分子稳定
D、在相同条件下,H2O的沸点比H2S的沸点
5、最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是
( )
A、CO2 B、C2H4O C、COCl2 D、H2O2
6、膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A、PH3分子中有未成键的孤对电子 B、PH3是非极性分子
C、PH3是一种强氧化剂 D、PH3分子的P-H键是非极性键
7、在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。例如下图表示的有机物中含有一个手性碳原子,具有光学活性。当发生下列变化时,生成的有机物无光学活性的是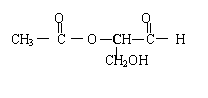 ( )
A、与新制的银氨溶液共热 B、与甲酸酯化
C、与金属钠发生置换反应 D、与H2加成
8、六氧化四磷(P4O6)的分子结构中只含有单键,且每个原子的最外层都满足8电子稳定结构,则该分子中含有的共价键的数目是:
A、10 B、12 C、24 D、28
9、有下列两组命题
( )
A、与新制的银氨溶液共热 B、与甲酸酯化
C、与金属钠发生置换反应 D、与H2加成
8、六氧化四磷(P4O6)的分子结构中只含有单键,且每个原子的最外层都满足8电子稳定结构,则该分子中含有的共价键的数目是:
A、10 B、12 C、24 D、28
9、有下列两组命题
|
A组 |
B组 |
|
Ⅰ、H-I键键能大于H-Cl键键能 |
①HI比HCl稳定 |
|
Ⅱ、H-I键键能小于H-Cl键键能 |
②HCl比HI稳定 |
|
Ⅲ、HI分子间作用力大于HCl分子间作用力 |
③HI沸点比HCl高 |
|
Ⅳ、HI分子间作用力大于HCl分子间作用力 |
④HI沸点比HCl低 |
B组命题正确且能用A组命题加以正确解释的是( ) A、Ⅰ① B、Ⅱ② C、Ⅲ③ D、Ⅳ④
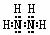 N2H4+2H2O2=N2+4H2O N2H4+2HCl=N2H6Cl2
18、
答案:①③⑨ ②④⑦ ⑤⑥⑧ ①②③⑥⑦⑧ ④⑤⑨ ⑦
①③⑤⑥⑧⑨ ②④⑤⑥⑧⑨
19、
答案:BF3中B的价电子结构为2s22p1,形成分子时,采取sp2杂化,三个sp2杂化轨道分别与三个F原子的p轨道成键,故BF3分子为平面三角形;NF3中的N价电子结构为2s22p3,形成分子时,采取sp3杂化,其中一个sp3杂化轨道为孤对电子占有,另三个电子分别与F成键,故分子结构为三角锥形。
20、
解析:考查“相似相溶原理”的理解,不但要会判断极性分子、非极性分子,还要会判断分子的结构,知道分子结构的相似性。相似相溶原理是从实验中归纳出的经验规律。一般非极性溶质(或极性小的)易溶于非极性溶剂,难溶于极性溶剂;强极性溶质易溶于极性溶剂,难溶于非极性溶剂。如多数有机物往往易溶于有机溶剂,多数盐易溶于水。
答案:⑴易溶 易溶 不易溶 不易溶
⑵不易溶 不易溶 易溶 易溶
原因: 分析这几种晶体和溶剂分子的结构可知,蔗糖、磷酸、水是极性分子,而碘、萘、四氯化碳是非极性分子。根据相似相溶原理,得出结论。
21、
(1)考查基本概念:配合物各部分名称的识记。
(2)根据VSEPR模型理论,把分子分为两大类:1、中心原子的价电子全都用于成键的,像BCl3,根据Abn,n=3时,结构是平面三角形;2、中心原子的价电子成键后还有孤对电子的,像H3O+,孤对电子也占据相当于成键原子的位置参与排斥,H3O+结构是三角锥形。
答案:(1)Ni、Cu2+、Fe3+ (2)三角锥形、平面三角形 (3)BF3、
N2H4+2H2O2=N2+4H2O N2H4+2HCl=N2H6Cl2
18、
答案:①③⑨ ②④⑦ ⑤⑥⑧ ①②③⑥⑦⑧ ④⑤⑨ ⑦
①③⑤⑥⑧⑨ ②④⑤⑥⑧⑨
19、
答案:BF3中B的价电子结构为2s22p1,形成分子时,采取sp2杂化,三个sp2杂化轨道分别与三个F原子的p轨道成键,故BF3分子为平面三角形;NF3中的N价电子结构为2s22p3,形成分子时,采取sp3杂化,其中一个sp3杂化轨道为孤对电子占有,另三个电子分别与F成键,故分子结构为三角锥形。
20、
解析:考查“相似相溶原理”的理解,不但要会判断极性分子、非极性分子,还要会判断分子的结构,知道分子结构的相似性。相似相溶原理是从实验中归纳出的经验规律。一般非极性溶质(或极性小的)易溶于非极性溶剂,难溶于极性溶剂;强极性溶质易溶于极性溶剂,难溶于非极性溶剂。如多数有机物往往易溶于有机溶剂,多数盐易溶于水。
答案:⑴易溶 易溶 不易溶 不易溶
⑵不易溶 不易溶 易溶 易溶
原因: 分析这几种晶体和溶剂分子的结构可知,蔗糖、磷酸、水是极性分子,而碘、萘、四氯化碳是非极性分子。根据相似相溶原理,得出结论。
21、
(1)考查基本概念:配合物各部分名称的识记。
(2)根据VSEPR模型理论,把分子分为两大类:1、中心原子的价电子全都用于成键的,像BCl3,根据Abn,n=3时,结构是平面三角形;2、中心原子的价电子成键后还有孤对电子的,像H3O+,孤对电子也占据相当于成键原子的位置参与排斥,H3O+结构是三角锥形。
答案:(1)Ni、Cu2+、Fe3+ (2)三角锥形、平面三角形 (3)BF3、