摘要:电解规律 电解类型 物质类型 电解反应 电解实质 电解质溶液中浓度变化 溶液pH变化 电解质溶液复原来 电解溶剂型 强碱 含氧酸(H2SO4) 活泼金属的含氧酸盐(Na2SO4) 电解溶质型 无氧酸(HCl) 不活泼金属的无氧酸盐(CuCl2) 溶质溶剂同时被电解 活泼金属的无氧酸盐 不活泼金属的含氧酸盐(CuSO4) 不活泼金属的含氧酸盐(AgNO3)
网址:http://m.1010jiajiao.com/timu3_id_58975[举报]
 按要求对下图中两极进行必要的连接并填空:
按要求对下图中两极进行必要的连接并填空:(1)在A图中,使铜片上冒H2气泡.请加以必要连接,则连接后的装置叫
原电池
原电池
.电极反应式:锌板:
Zn-2e-=Zn2+
Zn-2e-=Zn2+
;铜板:2H2++2e-=H2↑
2H2++2e-=H2↑
.(2)在B图中,使a极析出铜,则b析出:
O2
O2
.加以必要的连接后,该装置叫电解池
电解池
.电极反应式,a极:Cu2++2e-=Cu
Cu2++2e-=Cu
b极:4OH--4e-=O2↑+2H2O,
4OH--4e-=O2↑+2H2O,
.在经过一段时间后,停止反应并搅均溶液,溶液的pH降低
降低
(升高、降低、不变),加入一定量的CuO
CuO
后,溶液能恢复至与电解前完全一致.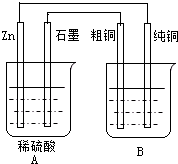 用右图装置能达到粗铜精炼的目的.
用右图装置能达到粗铜精炼的目的.(1)A烧杯是
原电池
原电池
(填〝电解池〞或〝原电池〞),B烧杯是电解池
电解池
(填〝电解池〞或〝原电池〞).(2)其中B烧杯中应该盛
硫酸铜溶液或其它易溶性的铜盐
硫酸铜溶液或其它易溶性的铜盐
溶液.(3)分别写出石墨棒和纯铜棒的电极反应式
石墨棒:
2H++2e-=H2↑
2H++2e-=H2↑
,纯铜棒:
Cu2++2e-=Cu
Cu2++2e-=Cu
.(4)若锌减少了0.65g,则纯Cu的质量增加了多少克?(写出计算过程)
 如图是一个化学过程的示意图,回答下列问题:
如图是一个化学过程的示意图,回答下列问题:(1)甲电池是
原电池
原电池
装置,乙池是电解池
电解池
装置.(2)通入CH3OH的电极名称是
负极
负极
,B电极的名称是阳极
阳极
;(3)写出甲池中的电极反应式
CH3OH-6e-+8OH-═CO32-+6H2O
CH3OH-6e-+8OH-═CO32-+6H2O
,O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;(4)乙池中反应的化学方程式为
4AgNO4+2H2O
4Ag+O2↑+4HNO3
| ||
4AgNO4+2H2O
4Ag+O2↑+4HNO3
.
| ||
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2
280
280
mL(标准状况下)(Fe:56 Ag:108) 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )