4.CO2气体中含少量SO2,将此混合气体通过下图所示的装置,可得到干燥纯净的CO2,则甲、乙两瓶中所装的试剂是 ( )
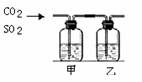
|
|
甲 |
乙 |
|
A |
NaOH溶液 |
浓硫酸 |
|
B |
浓硫酸 |
NaOH溶液 |
|
C |
饱和的NaHCO3溶液 |
浓H2SO4 |
|
D |
浓硫酸 |
饱和的Na2CO3溶液 |
20.(10分)铁在冷的浓硫酸中能发生钝化。某兴趣小组同学发现将一定量的铁与浓硫酸加热时,铁完全溶解,得到溶液A,并产生大量气体B。实验室现有下列试剂: 0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
Ⅲ.任意写出一个铁与浓硫酸加热时,可能发生的有关反应方程式
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量溶液A,滴入0.01 mol/L酸性KMnO4溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体B通入如下图装置 |
|
含有两种气体 |
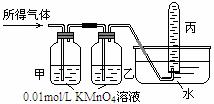
[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价: 。
19.(10分)减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的,利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
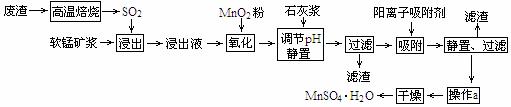
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、
Pb2+等其他金属离子。(提示:①在工业上,用沉淀法不能完全除去的离子还可以用 吸附法除去②有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表③阳离子 吸附剂吸附金属离子的效果见下图。④已知PbO2的氧化性大于MnO2。)
|
离子 |
离子半径(pm) |
开始沉淀pH |
完全沉淀pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中主要反应的一个化学反应方程式 ,
氧化过程中主要反应的一个离子反应方程式 。
(2)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
(3)决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷
c.金属离子的半径 d.吸附时间
(4)操作a包括 过滤、洗涤等过程。

 (3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?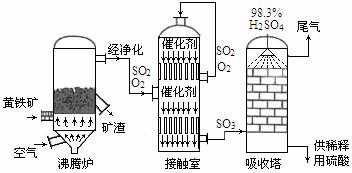
 :4
+11O2
:4
+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。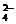 、S2-、SO
、S2-、SO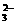 、Cl-、Br-、NO
、Cl-、Br-、NO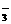 、CO
、CO