7.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
[答案]C
5. 表中①-⑥为短周期元素及相应部分原子半径的数据:
|
元 素 性 质 |
元 素 编 号
|
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径(nm) |
a |
0.075 |
b |
0.110 |
c |
d |
|
最 高 化 合 价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最 低 化 合 价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
下列说法正确的是( )
A. 元素①的最外层电子排布为2S22P4
B. 元素②氢化物与元素⑥氢化物之间反应形成化合物中只有极性键
C. 原子半径:a>d>b>c
D. 非金属性:元素⑤>元素④>元素①
[答案]C
[解析]先从化合价角度分析,最高正价为最外层电子数,最低价的绝对值为8减最外层电子数。元素①和元素③同在ⅥA族,由于O无最高正价,可确定元素①为S和元素③为O元素;元素②和元素④同在ⅤA族,半径大小②< ④,马上确定元素②为N元素④为P元素;元素①的最外层电子排布为3S23P4;NH3与HCl生成NH4Cl中含有离子键和极性键;原子半径大小应为S>Cl>O>F,即a>d>b>c;非金属性:元素⑤>元素①>元素④,即F>S>P。选C
 A.X的原子半径一定大于Y的原子半径
A.X的原子半径一定大于Y的原子半径 [答案]D
[答案]D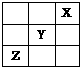 A. X是活泼的非金属
A. X是活泼的非金属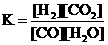 (2)放热
(2)放热 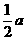 x mol x mol x mol (a- x)mol x mol
x mol x mol x mol (a- x)mol x mol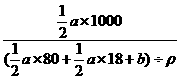
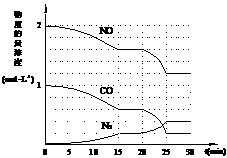 (1)1.0×10-6
(1)1.0×10-6  ② 0.4/15 mol·L-1·min-1
② 0.4/15 mol·L-1·min-1