22.(福建08-09学年福州三中高三理科综合试卷)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)
__________________________________________________________________。
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
|
KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间
t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
0.01 |
14 |
13 |
11 |
|
0.001 |
6 |
 7 7 |
7 |
① 计算用0.001 mol·L-1
KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程)

② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:_________________________________________________________
[答案](1)2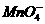 + 5H2C2O4 + 6H+
= 2Mn2+ + 10CO2↑+ 8H2O (2)4
+ 5H2C2O4 + 6H+
= 2Mn2+ + 10CO2↑+ 8H2O (2)4
(3)①
反应开始时:c(KMnO4)=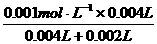 =0.00067
mol·L-1
=0.00067
mol·L-1
反应时间: =
=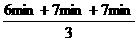 =6.7min
=6.7min
KMnO4的平均反应速率:
ν(KMnO4)=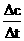 =
=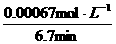 =1×10-4
mol·L-1·min-1
=1×10-4
mol·L-1·min-1
② 否(或:不可行) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应 高
高
 (山东省聊城一中08-09高三期末综合)密度为1.45 g/cm3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为
( )
(山东省聊城一中08-09高三期末综合)密度为1.45 g/cm3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为
( ) (山东省临沭一中2009届高三上学期期中考试)用NA表示阿伏加德罗常数,下列说法中正确的是
( )
(山东省临沭一中2009届高三上学期期中考试)用NA表示阿伏加德罗常数,下列说法中正确的是
( )

 固体加热时未充分反应变为 Fe2O3
固体加热时未充分反应变为 Fe2O3  NH3·H2O + H+
NH3·H2O + H+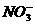 )> c (
)> c (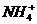 ) > c (H+) > c (
) > c (H+) > c (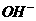 )
)