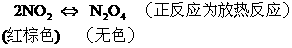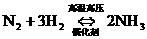15.物质的生成热可定义为:由稳定单质生成1mol物质所放出的热量,如CO2气体的生成热就是1molC完全燃烧生成CO2气体时放出的热量,已知下列几种化合物的生成热分别是
|
化合物 |
葡萄糖 |
H2O(l) |
CO2 |
|
生成热kJ/mol |
1259.8 |
285.8 |
393.5 |
则1kg葡萄糖在人体内完全氧化生成CO2气体和液态水,最多可提供______kJ能量。
答案:15640kJ
评析:根据生成热的定义得下面三个方程:6C(s)+3O2(g)+6H2(g)=C6H12O6(s);ΔH=-1259.8kJ/mol……①,C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol……②;O2(g)+2H2(g)=2H2O(l)……③,联立求解即得。
[小结]全面了解化学反应,除要知道反应物和生成物之外,还需要研究化学反应发生的条件,应用化学反应,一方面是为了获得新物质,有时更重要的是要利用化学反应中的热变化,而放热反应和吸热反应是化学反应中最常见的能量变化,因此我们要了解一些常见的吸热反应和放热反应。
依据热化学方程式进行有关计算,其关键是把反应热看作为“生成热”,按一般化学方程式的计算要求进行即可,但多数题目偏重于对方法技巧的考查。
 eC(气)+fD(气)反应过程中,当其他条件不变时,C的体积分数j(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是
( )
eC(气)+fD(气)反应过程中,当其他条件不变时,C的体积分数j(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是
( )
 例2.已知某可逆反应mA(g)+nB(g)
例2.已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
( )
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
( )
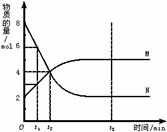
 N B.t2时,正逆反应速率相等,达到平衡
N B.t2时,正逆反应速率相等,达到平衡 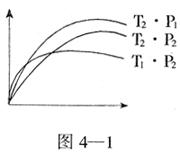 例4.反应 2X(气)+
Y(气)
例4.反应 2X(气)+
Y(气)