摘要:催化剂能同等程度的增加正反应速率和逆反应速率,即,催化剂不能改变达到化学平衡状态的反应混合物的组成.即:催化剂不能使化学平衡移动!但催化剂可以改变达到化学平衡所需要的时间.
网址:http://m.1010jiajiao.com/timu3_id_51146[举报]
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应向正向进行的程度越大
反应向正向进行的程度越大
,K值大小与温度的关系是:温度升高,K值可能增大也可能减少
可能增大也可能减少
(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如下图所示,则0~4min的平均反应速率v(CO)=
0.03
0.03
mol/(L?min)t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.006 | 0.266 | 0.104 |
①表中3min~4min之间反应处于
平衡
平衡
状态;C1数值大于
大于
0.08mol/L (填大于、小于或等于).②反应在4min~5min之间,平衡向逆方向移动,可能的原因是
d
d
(单选),表中5min~6min之间数值发生变化,可能的原因是a
a
(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
CO与H2二者发生如下的化学反应:CO(g)+2H2(g)?CH4O(g)△H<0,该反应的产物甲醇是化学工业重要的基础原料.
(1)该反应中氧化剂是______.相同温度下,1molCO完全燃烧的焓变为△H1,1molCH4O(g)完全燃烧的焓变为△H2,则△H1与△H2的关系为△H1______△H2(填“>”、“<”或“=”).
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=______,化学平衡常数K=______.
下列表示该反应过程的示意图正确的是______(填字母).
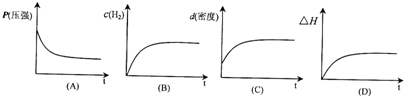
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比______(填“增大”、“减小”、“不变”).
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则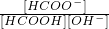 与稀释前比较______(填字母)
与稀释前比较______(填字母)
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是______(填字母).
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是______.
查看习题详情和答案>>
(2013?烟台模拟)CO与H2二者发生如下的化学反应:CO(g)+2H2(g)?CH4O(g)△H<0,该反应的产物甲醇是化学工业重要的基础原料.
(1)该反应中氧化剂是
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
下列表示该反应过程的示意图正确的是
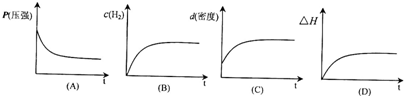
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
与稀释前比较
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
查看习题详情和答案>>
(1)该反应中氧化剂是
CO
CO
.相同温度下,1molCO完全燃烧的焓变为△H1,1molCH4O(g)完全燃烧的焓变为△H2,则△H1与△H2的关系为△H1>
>
△H2(填“>”、“<”或“=”).(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
0.06mol/(L.min)
0.06mol/(L.min)
,化学平衡常数K=9.375(mol/L)-2
9.375(mol/L)-2
.下列表示该反应过程的示意图正确的是
A
A
(填字母).
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
增大
增大
(填“增大”、“减小”、“不变”).(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
| [HCOO-] | [HCOOH]?[OH-] |
C
C
(填字母)A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
C
C
(填字母).A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是
混合后溶液中Qc=Ka
混合后溶液中Qc=Ka
.(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时
值将______(填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是 92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是 .
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为 .向此溶液中加入少量的氯化铵固体,此时
值将 (填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=