23. (8分)有两份溶液,其中所含溶质相同,设其摩尔质量为M g/mol。
根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
w1 |
d1 |
|
第二份溶液 |
w 2 |
d2 |
(1)第一份溶液中,溶质的物质的量浓度为_______________________。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数w 3=________。
(3)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,试比较w3、w4的相对大小?______________________; ___________________________。
毕业班第二次联考试题
22. (8分)现有只含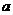

 的溶液,欲使其变成只含
的溶液,欲使其变成只含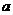

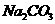 的溶液,可采取下列方法,试写出有关物质的化学式。
的溶液,可采取下列方法,试写出有关物质的化学式。
(1) 只加入0.5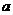
 的纯净物A,
的纯净物A,
则A可能是 或 。
(2)只加入
 的纯净物B,
的纯净物B,
则B可能是 或 。
20. (10分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃-80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
|
物质 |
乙醛 |
乙酸 |
甘油 |
水 |
|
沸点 |
20.8℃ |
117.9℃ |
290℃ |
100℃ |
请回答下列问题:
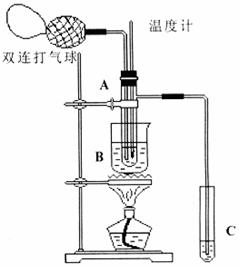 (1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件)
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式为(注明反应条件)
__________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内的主要反应完成后温度计水银球的位置应在___________________;
(3)烧杯B内盛装的液体可以是_______
供选择的试剂有;
乙酸; 甘油; 水
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、酚酞试液、碳酸氢钠粉末。实验仪器任选。
该方案为________________________________________________________。
____________________________________________________
18. (8分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。根据已学知识回答下列问题:已知:
|
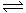 2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
(1)合成氨工业中采取的下列措施不可用勒沙特列原理解释的是 (填序号)
A、采用较高压强(20Mpa~50Mpa) B、采用500℃的高温
C、用铁触媒作催化剂 D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)1998年两位希腊化学家在《科学》杂志上发表论文,称他们在常压下把氢气和用氦气稀释的氮气分别通人一个加热到570℃的电解池(图1)中,氢和氮在电极上合成了氨,且转化率达到了78%。用来合成氨的电解质在电解池里起传导H+离子的作用(见图1),它是一种固体复合氧化物(缩写为SCY),具有钙钛矿晶体构型(最小重复单元见图2),电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。
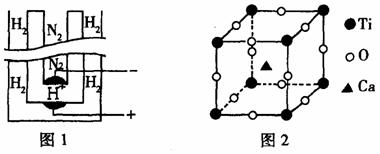
①阴极的电极反应方程式为____________________________
②钙钛矿晶体中,每个钛原子周围与它最接近且等距离的钛原子共有 个,氧、钙、钛(Ti)的原子个数比是 。
16. 据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是
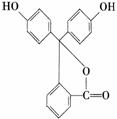 A.酚酞的分子式为C20H14O4
A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗 3 mol NaOH
毕业班第二次联考化学试题
第Ⅰ卷选择题答案栏
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(60分)
(本卷七个大题,每空2分)
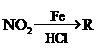 -
-

 至少有 个原子在同一平面上。
至少有 个原子在同一平面上。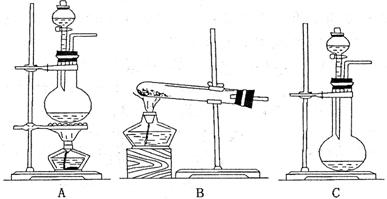
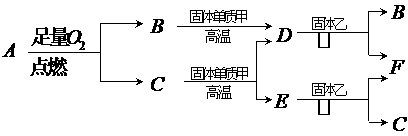
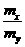 <3,则气体A中肯定有(写化学式)
。
<3,则气体A中肯定有(写化学式)
。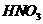 的离子方程式为:
。
的离子方程式为:
。 右上图中a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是
右上图中a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是