21.(B)[实验化学]
阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
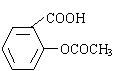
 + (CH3CO)2O
+ (CH3CO)2O 

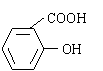
 + CH3COOH
+ CH3COOH
|

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃-90℃条件下反应5-10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2-3 min,直到没有二氧化碳气体产生为止。过滤,用5-10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1-2次,再抽干水分,即得产品。
请回答下列问题:
⑴第①步中,要控制温度在85℃-90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
⑵在第②步中,用冷水洗涤晶体,其目的是 、 。
⑶在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
⑷如何检验产品中是否混有水杨酸? 。
18.(8分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
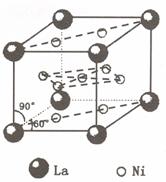
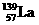 ) 和镍(
) 和镍(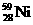 ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外, E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子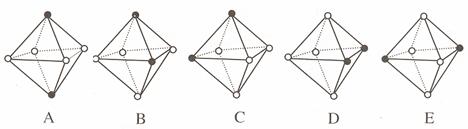
 (3)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
(3)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
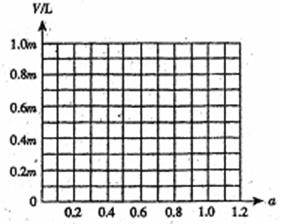 (已知CaO+3C
CaC2+CO;
(已知CaO+3C
CaC2+CO;
 C2的化学方程式
。
C2的化学方程式
。
 (C4H9)2CuLi
(C4H9)2CuLi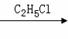 C4H9-C2H5
C4H9-C2H5
 B
B 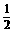 H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填分子式或名称)。石膏定型时发生的化学反应方程式
。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是 (填分子式或名称)。石膏定型时发生的化学反应方程式
。 12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,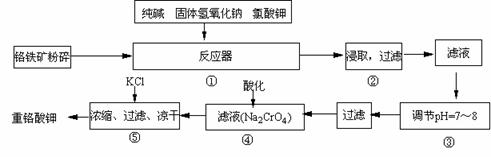
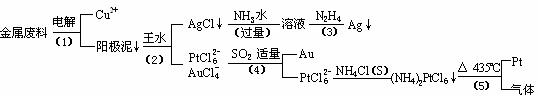
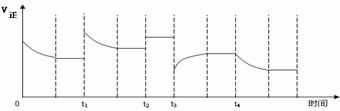 合成氨反应:N2(g)
+ 3H2(g)
合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图: