摘要:15.从含银.铜.金和铂的金属废料中提取金.银.铂的一种工艺如下: 根据以上工艺回答下列问题: (1)电解时.以金属废料为阳极.纯铜为阴极.CuSO4溶液为电解液.写出电解反应的阳极方程式: : 的离子反应方程式: , (3)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O 但该反应的平衡常数很小.所以金和浓硝酸几乎不反应.但金却可以溶于王水.试简要解释之: . (4)我们知道.稀盐酸与铜不反应.在稀盐酸中加入H2O2等氧化剂后.则可使铜顺利溶解.某同学未加入氧化剂.而是设计了一个实验装置.也能使铜溶于稀盐酸.请在方格中画出该装置: (5)分别将等质量的铜片与分别等体积.过量的浓硝酸.稀硝酸反应.所得到的溶液前者呈绿色.后者呈兰色.甲同学提出可能是Cu2+浓度不同引起的.乙同学提出溶液呈“绿色 是溶液中Cu2+与NO2共存的结果.请你设计实验探究甲乙两同学的说法谁更正确(简述实验方案和实验现象及由此得出的结论:
网址:http://m.1010jiajiao.com/timu3_id_43382[举报]
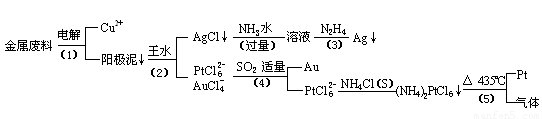
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:

根据以上工艺回答下列问题:
(1)电解时,以
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
(3)写出步骤(4)的离子反应方程式:
(4)王水是
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
查看习题详情和答案>>

根据以上工艺回答下列问题:
(1)电解时,以
金属废料
金属废料
为阳极,纯铜为阴极,CuSO4溶液为电解液,则阳极的电极反应式为:Cu-2e-→Cu2+
Cu-2e-→Cu2+
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O2[Ag(NH3)2]++2OH-+CH2OH(CHOH)4CHO 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
; 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O(3)写出步骤(4)的离子反应方程式:
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
2AuCl4-+3SO2+6H2O=2Au+8Cl-+3SO42-+12H+
;(4)王水是
浓盐酸和浓硝酸
浓盐酸和浓硝酸
的混合液,其体积比为:3:1
3:1
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水
.
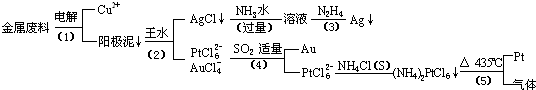
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:阳极: ,阴极: ;
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出.
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式: ;
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之: .
查看习题详情和答案>>

根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电极反应式:阳极:
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
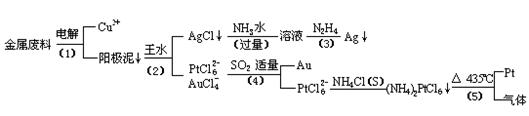
从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
根据以上工艺回答下列问题:
电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
查看习题详情和答案>>