5.从下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->H3AlO3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
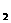 和Br
和Br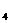 和CuSO
和CuSO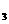 溶液中,已电离的水分子数
溶液中,已电离的水分子数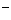 和H
和H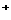 的离子半径
的离子半径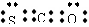 A.羰基硫属于非极性分子
A.羰基硫属于非极性分子 ,NH4Cl的电子式为:
,NH4Cl的电子式为: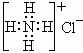
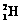 )受控核聚变成氦(
)受控核聚变成氦(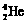 )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是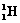 2和
2和 ⑴原混合液中H2SO4和HCl的物质的量浓度
⑴原混合液中H2SO4和HCl的物质的量浓度
 在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示: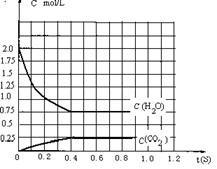 ⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。
⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。 C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是 2NH3达到平衡的标志是
2NH3达到平衡的标志是 (A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰
(A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰 ⑴写出有关物质的名称或化学式:
⑴写出有关物质的名称或化学式: