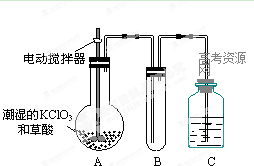
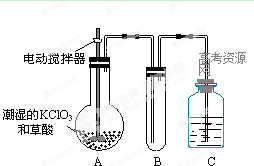
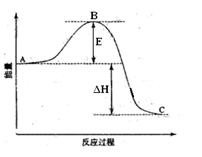
网址:http://m.1010jiajiao.com/timu3_id_430153[举报]

(2)当反应物中含有1.4mol钠离子,上述反应恰好完全进行时,电子转移总数为____NA。
(3)Na2FeO4代替Cl2是因为它具有__________性,还原为Fe3+后净水的原理为(用离子方程式表示)_________
(4)某厂制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中
①NaCl ②NH4Cl ③KMnO4 ④浓H2SO4,能使NaNO2转化为N2(不引起二次污染的)是______(选填编号),反应离子方程式___________________________