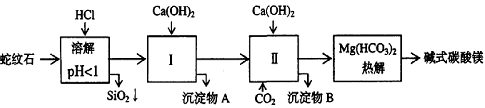
27.(13分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________。
(2) 进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,
若Ca(OH)2过量可能会导致 溶解、产生 沉淀。
(3) 从沉淀混合物A中提取红棕色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________(填写物质化学式)。
(5)若产品组成可表示为aMgCO3·bMg(OH)2·cH2O,己知18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________、b=_________、c=_________。
惠安第一中学2011届高三年第一次月考化学学科试卷
26.(13分)已知A、B、C、D都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、B原子的L层有2个未成对电子,C的三价阳离子与B的阴离子具有相同的电子层结构。D3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出B原子的核外电子排布式: ;D元素在周期表中处于_____
周期______族。
(2)A的最简单氢化物的分子空间构型是: ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)C元素最高价氧化物对应水化物可用于治疗胃酸过多,写出其反应的离子方式__________________________________;
(4)H2S和B元素的氢化物(分子式为H2B2)的主要物理性质比较如下
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2B2 |
272 |
423 |
以任意比互溶 |
H2S和H2B2的相对分子质量基本相同,造成上述物理性质差异的主要原因: ;
(5)D和M(质子数为25)两元素的部分电离能数据列于下表:
元 素 素 |
M |
D |
|
|
电离能 (kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态D2+再失去一个电子难。对此,你的解释是 ;
25、(10分)北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于方框内)
□ KIO3 + □KI + □H2SO4 = □K2SO4 + □I2 + □H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:
。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是:________________________________;
②b中反应所产生的I2的物质的量是: mol;
 A.三聚氰胺属于有机物
A.三聚氰胺属于有机物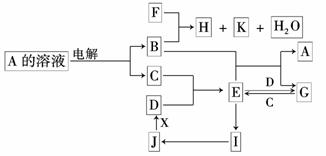 (12分)中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体;B与E反应生成A与G是腐蚀法制作印刷电路版的反应原理; J 为红棕色固体.请回答下列问题:
(12分)中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体;B与E反应生成A与G是腐蚀法制作印刷电路版的反应原理; J 为红棕色固体.请回答下列问题: