
已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
|
密度/g·mL-1 |
沸点/℃ |
溶解性 |
|
溴乙烷 |
1.461 |
38 |
难溶于水 |
|
乙醇 |
0.789 |
78 |
易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,本实验采取了 ____________________________________________________________的措施。
32. (16分)
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁的化合物。
(1)黄铜矿的组成元素中,属于副族元素的是__________(填写名称,下同);属于主族元素的是_____,它位于周期表的位置是__________,它的原子半径________Cl的原子半径(填“>”、“<”或“=”,下同),它的气态氢化物的稳定性____HCl。
(2)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),氧化产物是___________(填化学式)。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (请配平)。
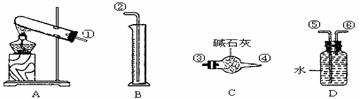
23.(10分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种,某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含 一种;Ⅱ.所得气体的成分可能含有 二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
[实验探究]
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想 正确;
(3)实验过程,仪器C的作用是 ;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
|
① |
6.4 |
2.88 |
224 |
|
② |
6.4 |
2.56 |
448 |
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组 ;
②组 。

 、NH4+、Mg2+、Ba2+、
、NH4+、Mg2+、Ba2+、 、
、 -。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验: 内容 实验结果
内容 实验结果 的体积)
的体积) 由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则: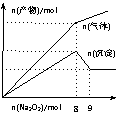 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg 2+、NH4+的物质的量分别为 ( )
2+、NH4+的物质的量分别为 ( )