24.(12分)哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
26.有一无色透明溶液,欲确定是否含有下列离子: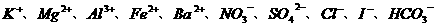 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
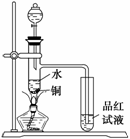
(2)取少量该溶液加热浓缩,加Cu片和浓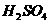 ,加热 ,加热 |
有红棕色气体产生 |
(3)取少量该溶液,加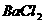 溶液 溶液 |
有白色沉淀生成 |
(4)取(3)中上层清液,加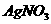 溶液 溶液 |
有白色沉淀生成,且不溶于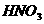 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是__________________,溶液中肯定不存在的离子是_______________________。
(2)还应进一步检验的离子名称及应该补充的实验(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤)_____________________________________________________________________________________________________________________________________________。
 ③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84
g·cm-3,根据以上信息回答:
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84
g·cm-3,根据以上信息回答: 


 KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O
KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O